
【题目】肼( ![]() )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼.
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:
(2)已知:①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1
②N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJmol﹣1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:
(3)已知断裂1mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N﹣N为154、H﹣O为464、请根据N2H4(l)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJmol﹣1中数据计算断裂1molN﹣H键所需的能量(kJ)是:
(4)写出NH3与NaClO反应得到肼的化学方程式: .
【答案】
(1)2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol
(3)403
(4)2NH3+NaClO=N2H4+NaCl+H2O
【解析】解:(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O,所以答案是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,所以答案是:2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;(2)①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1根据盖斯定律写出肼和N2O4反应的热化学方程:②×2﹣①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;所以答案是:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;(3)设断裂1molN﹣H键所需的能量为x,由反应及焓变等于反应物中键能之和﹣生成物中键能之和可知, 4x+154+498﹣942﹣2×2×464=﹣534,解得x=403(kJ),所以答案是:403;(4)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,所以答案是:2NH3+NaClO=N2H4+NaCl+H2O.
CaCl2+2NH3↑+2H2O;(2)①N2(g)+2O2(g)=N2O4(l)△H1=﹣195kJmol﹣1②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1根据盖斯定律写出肼和N2O4反应的热化学方程:②×2﹣①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;所以答案是:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣873.4kJ/mol;(3)设断裂1molN﹣H键所需的能量为x,由反应及焓变等于反应物中键能之和﹣生成物中键能之和可知, 4x+154+498﹣942﹣2×2×464=﹣534,解得x=403(kJ),所以答案是:403;(4)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,所以答案是:2NH3+NaClO=N2H4+NaCl+H2O.


科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CO(g)=2C(s)+O2(g)的△H为正值,△S为负值.设△H和△S不随温度改变,下列说法中正确的是( )
A.低温下能自发进行
B.高温下能自发进行
C.低温下不能自发进行,高温下能自发进行
D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将117g NaCl溶于水配制成1L溶液,
(1)该溶液中NaCl的物质的量浓度为 , 溶液中Cl﹣的物质的量浓度为 .
(2)配制1molL﹣1的NaCl溶液500mL,需该溶液的体积为 .
(3)向该溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3molL﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为 , 通入HCl气体的体积(标准状况下)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】21世纪是钛的世纪.在800℃~1000℃时电解TiO2可制得钛,装置如图所示.下列叙述正确的是( ) 
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为:TiO2+4e﹣═Ti+2O2﹣
D.每生成0.1mol钛,转移电子0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( ) 
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= ![]() mol?L﹣1?min﹣1
mol?L﹣1?min﹣1
C.M点的正反应速率V正大于N点的逆反应速率V逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示: 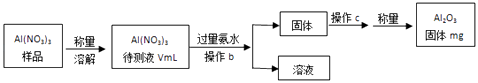
①加入过量氨水后发生反应的离子方程式为: .
②操作b为:
③Al(NO3)3待测液中,c(Al3+)=mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示: 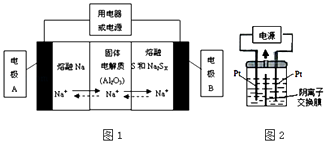
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050、 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据表数据,请你判断该电池工作的适宜应控制在(填字母)范围内.
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为极,电极B发生反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为: .
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:;试分析左侧溶液蓝色逐渐变浅的可能原因是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,若VL甲烷(CH4)中含有的氢原子个数为n,则阿伏加德罗常数可表示为 ( )
A. Vn/22.4 B. 22.4n/V
C. Vn/5.6 D. 5.6n/V
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
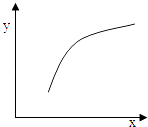
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com