
| A、0.15 mol |
| B、0.30 mol |
| C、0.35 mol |
| D、0.4 mol |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、铜片上有气泡逸出 |
| B、溶液的pH逐渐减小 |
| C、电子由铜片经导线流向锌片 |
| D、该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用广泛pH试纸测得某溶液的pH为6.3 |
| B、某常见气体的密度为1.8g?cm-3 |
| C、某澄清石灰水的浓度是2.0mol?L-1 |
| D、某元素的原子半径是111pm |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、HOCH2COOH的缩聚物是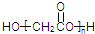 |
B、乙醛和丙烯醛(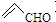 )不是同系物 )不是同系物 |
| C、已知甲醛分子中各原子共平面,则丙烯醛所有原子一定共平面 |
| D、结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子的单体是1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3 |
| B、Na2O |
| C、Na2S |
| D、Na2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com