
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
分析 ①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有Cu2+离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有Al3+离子,E中含有OH-离子;
③进行焰色反应实验,只有B、C为紫色,则B、C含有K+离子,结合离子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有HCO3-离子,C、D中产生白色沉淀,则C、D中含有SO42-离子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是KNO3.
解答 解:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有Cu2+离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有Al3+离子,E中含有OH-离子;
③进行焰色反应实验,只有B、C为紫色,则B、C含有K+离子,结合离子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有HCO3-离子,C、D中产生白色沉淀,则C、D中含有SO42-离子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是KNO3.
(1)由上述分析可知,A为NaHCO3,B为KNO3,C为KAl(SO4)2,D为CuSO4,
故答案为:NaHCO3;KNO3;KAl(SO4)2;CuSO4;
(2)A是NaHCO3,E是NaOH,1mol A的溶液与含1mol E的溶液反应生成碳酸钠和水,蒸干过程中碳酸钠水解得到碳酸氢钠与氢氧化钠,最终二者又反应得到Na2CO3,
故答案为:Na2CO3 ;
(3)实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(4)C中含有铝离子,铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水 中的悬浮物而净水,水解反应方程式为:Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+.
点评 本题考查无机物推断,属于未知物的检验推断,涉及离子共存、离子反应等,关键明确离子之间发生的反应现象,有利于培养学生的逻辑思维推理能力和,难度中等.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
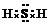 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )| A. | 该物质的分子式为S4N4 | |
| B. | 该物质的分子中既有极性键又有非极性键 | |
| C. | 该物质的分子中N、S原子均采取sp3杂化 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | I | K | |||
| 3 | B | C | D | G | J |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+) | B. | c(H+)>c(OH-) | ||
| C. | 2 c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2 c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

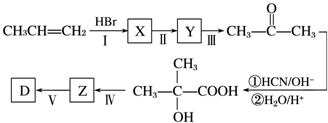
 ;
; ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com