
| 元素 | 相关信息 |
| X | X的一种核素的质量数为18,中子数为10 |
| Y | Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的基态原子核外有4个未成对电子 |
 ,
, ;
;

科目:高中化学 来源: 题型:
| pH值 | 6.5-8.5 |
| Ca2+、Mg2+总浓度 | <0.045mol/L |
| 细菌总数 | <100个?mL-1 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
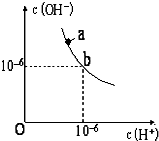 回答下列问题.
回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
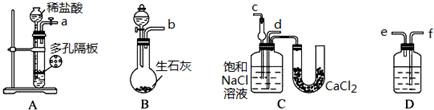
查看答案和解析>>
科目:高中化学 来源: 题型:
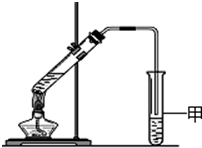 通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
通过粮食发酵可获得某含氧有机物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②④ |
| C、①③④ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com