
| A. | 在普通钢中加入镍、铬等多种元素可炼成不锈钢 | |
| B. | 硬铝、青铜、金箔都属于合金,合金的性能一般优于纯金属 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着致密的氧化膜,对内部金属起保护作用 |
分析 A.不锈钢制品就是在普通钢中添加铬、镍等元素改变了钢铁内部结构;
B.金箔是一种物质组成的纯净物;
C.镁条燃烧生成白色固体氧化镁,反应过程中发出耀眼的白光;
D.铝是活泼金属,和氧气反应,在表面生成氧化铝膜保护金属.
解答 解:A.不锈钢制作就是在普通钢中添加铬、镍等元素改变了钢铁内部结构,不锈钢是合金属于混合物,故A正确;
B.硬铝、青铜都属于合金,金箔不是合金,合金的性能一般优于纯金属,故B错误;
C.金属的性质决定金属的用途,制造照明弹就是利用了镁燃烧发出耀眼的白光,故C正确;
D.铝与氧气反应生成致密的氧化铝保护膜,对内部金属起保护作用,故D正确,
故选B.
点评 本题考查合金的概念与用途、铁合金、镁铝元素单质化合物的性质等,比较基础,注意对基础知识的积累掌握,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解MgO制取Mg | |
| B. | 加热条件下用CO还原Ag2O制取Ag | |
| C. | 在A1和F2O3反应中,生成11.2gFe,转移电子数为0.6NA | |
| D. | 电解NaCl溶液制取Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量乙酸与碳酸钠溶液反应:2 CH3COOH+CO32-→2CH3COO-+CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,造成钢铁腐蚀的主要原因是化学腐蚀 | |
| B. | MgO、Al2O3是耐高温材料,工业上常用其电解冶炼对应的金属 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用热的纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
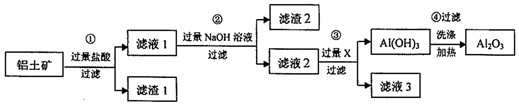
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
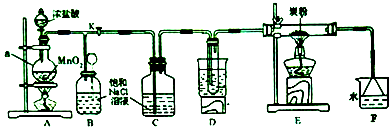
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com