
��1��һ�������£����淴Ӧ��A2(g)+B2(g)  2C(g)�ﵽƽ��ʱ�������ʵ�
2C(g)�ﵽƽ��ʱ�������ʵ�
ƽ��Ũ�ȷֱ�Ϊ��c(A2)��0.5 mol��L-1��c(B2)��0.1 mol��L-1��c(C)��1.6 mol��L-1��
����a��b��c�ֱ��ʾA2��B2��C�ij�ʼŨ�ȣ�mol��L-1)����
��a��bӦ����Ĺ�ϵʽ�� ��
��a��ȡֵ��Χ�� ��
��2����Ԫ�ص��⻯����������ڹ�ҵ�������������ж��й㷺Ӧ�ã��£�N2H4����
��Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪����N2(g)+2O2(g)="===" N2O4 (1) ��H1= -19.5kJ��mol-1
��N2H4(1)+O2(g)="===" N2(g)+2H2O(g) ��H2= -534.2kJ��mol-1
д���º�N2O4��Ӧ���Ȼ�ѧ����ʽ ��
(1)��a=b+0.4 ��0.4<a<1.3
(2) 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g) ��H=-1048.9kJ/mol(3��)
���������������1��һ�������£����淴Ӧ��A2(g)+B2(g)  2C(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ�ȷֱ�Ϊ��c(A2)��0.5 mol��L-1��c(B2)��0.1 mol��L-1��c(C)��1.6 mol��L-1����B2(g)��ȫ��Ӧ����aΪ0.4����bΪ0����Cȫ��ȫ��ת��ΪA2(g)+B2(g)����aΪ1.3��bΪ0.9�����Ԣ�a��bӦ����Ĺ�ϵʽ��a=b+0.4���������Ǽ���״̬����a��ȡֵ��Χ��0.4<a<1.3����2���º�N2O4��Ӧ���Ȼ�ѧ����ʽ�����ɢ�N2H4(1)+O2(g)="===" N2(g)+2H2O(g)����2���ټ�ȥ��N2(g)+2O2(g)="===" N2O4�õ������º�N2O4��Ӧ���Ȼ�ѧ����ʽΪ 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g��H=-1048.9kJ/mol������H=-534.2��2+19.5=-1048.9kJ/mol����
2C(g)�ﵽƽ��ʱ�������ʵ�ƽ��Ũ�ȷֱ�Ϊ��c(A2)��0.5 mol��L-1��c(B2)��0.1 mol��L-1��c(C)��1.6 mol��L-1����B2(g)��ȫ��Ӧ����aΪ0.4����bΪ0����Cȫ��ȫ��ת��ΪA2(g)+B2(g)����aΪ1.3��bΪ0.9�����Ԣ�a��bӦ����Ĺ�ϵʽ��a=b+0.4���������Ǽ���״̬����a��ȡֵ��Χ��0.4<a<1.3����2���º�N2O4��Ӧ���Ȼ�ѧ����ʽ�����ɢ�N2H4(1)+O2(g)="===" N2(g)+2H2O(g)����2���ټ�ȥ��N2(g)+2O2(g)="===" N2O4�õ������º�N2O4��Ӧ���Ȼ�ѧ����ʽΪ 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g��H=-1048.9kJ/mol������H=-534.2��2+19.5=-1048.9kJ/mol����
���㣺��ѧƽ��ļ��㡢�Ȼ�ѧ����ʽ����д
���������⿼���˻�ѧƽ��ļ��㡢�Ȼ�ѧ����ʽ����д���ÿ����Ǹ߿�������ȵ㣬��������������ѧ���Ի�ѧƽ�������������������Ѷ��еȡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ���� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��
�� -CH2COOH+HCl
-CH2COOH+HCl ��
�� -CH2COOH+HCl
-CH2COOH+HCl| ±���� | F3CCOOH | Cl3CCOOH | F2CHCOOH | FCH2COOH | CH3CH2CHClCOOH |
| pKa | 0.23 | 0.65 | 1.24 | 2.66 | 2.85 |
| ±���� | ClCH2COOH | BrCH2COOH | ICH2COOH | CH3CHClCH2COOH | Cl��CH2CH2CH2COOH |
| pKa | 2.86 | 2.90 | 3.18 | 4.06 | 4.52 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| �� |
| ���� |
| �� |
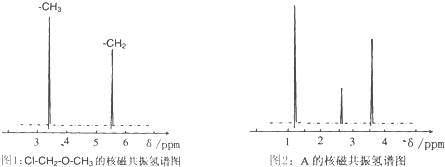
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���� |
| 8 |
| 3 |
| 8 |
| 3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com