
“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①④⑤ B.②③④
C.②③⑤ D.①③④⑥
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
通过化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟含有哪些物质。正确解答此类试题的关键:(1)猜测要全面;(2)熟记常见物质的检验方法。
| [典例] | 审题指导 |
| 某研究性学习小组用下列装置(铁架台等夹持仪器略)探究氧化铁与乙醇的反应,并检验反应产物。 | 联想:乙醇的催化氧化。 |
| (1)用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是________________________________________________________________________。 | 新制Cu(OH)2悬浊液与醛基的反应需要碱性条件。 |
| (2)为快速得到乙醇气体,可采用的方法是________________________________________________________________________。 若实验时小试管中的溶液已经开始发生倒吸,可采取的措施是________(填字母)。 a.取下小试管 b.移去酒精 c.将导管从乳胶管中取下 d.以上都可以 | ①升高温度可加速乙醇的挥发。 ②若液体倒吸入加热的反应管,可能会造成反应管炸裂,取下小试管已无济于事,因“溶 液已经开始发生倒吸”。 |
| (3)如图实验,观察到红色的Fe2O3全部变为黑色固体M,充分反应后停止加热。取下小试 管,加热,有砖红色沉淀生成。 为了检验M的组成,进行下列实验。 ①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成; ②经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是_____________________;证明溶液含有亚铁离子的方法是________________________________________________________________________。 能得出的结论是________(填字母)。 a.M中一定有+3价和+2价铁,不能确定是否有0价铁 b.M中一定有+3价和0价铁,无+2价铁 c.M中一定有+3价铁,0价和+2价铁至少有一种 d.M中一定有+3价、+2价和0价铁 | 破题关键 分析黑色固体(M)可能的成分,铁的氧化物Fe3O4、FeO和铁粉均为黑色,Fe3O4中既有+3价铁又有+2价铁,且具有磁性,Fe3+能溶 解单质铁。 易错警示 已知溶液中有Fe3+,检验Fe2+不能用KSCN 溶液。 |
| (4)若M的成分可表达为FexOy,用CO还原法定量测定其化学组成。称取m g M样品进行定量测定,实验装置和步骤如下:
①组装仪器;②点燃酒精灯;③加入试剂;④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧…… 正确的操作顺序是________(填字母)。 a.①⑤④③②⑥⑦⑧ b.①⑤③④②⑥⑦⑧ c.①③⑤④②⑦⑥⑧ d.①③⑤②④⑥⑦⑧ 若M完全被还原后碱石灰增重n g,则 | 破题关键 Ⅰ.检查气密性属于实验的准备阶段,应在加药品前进行。 Ⅱ.类比氢气还原氧化铜。 Ⅲ.碱石灰增加的质量即为反应产生的CO2的质量,得关系式M中n(O)=n(CO2)。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
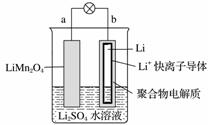
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )
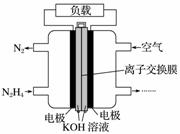
A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为N2H4+4OH--4e-===N2+4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学反应中,反应前与反应后相比较,肯定不变的是 ( )。
①元素的种类 ②原子的种类 ③分子的数目 ④原子的数目 ⑤反应前物质的质量总和与反应后物质的质量总和 ⑥如果在水溶液中反应,反应前与反应后阳离子所带的正电荷总数
A.①②③④ B.①②⑤⑥
C.①②④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方程式①AgCl(s)Ag+(aq)+Cl-(aq)、
②AgCl===Ag++Cl-、 ③CH3COOHCH3COO-+H+各表示什么意义?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时BaSO4饱和溶液中存在BaSO4(s)Ba2+(aq)+SO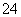 (aq),Ksp=1.102 5×10-10,向c(SO
(aq),Ksp=1.102 5×10-10,向c(SO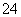 )为1.05×10-5 mol·L-1的BaSO4溶液中加入BaSO4固体,SO
)为1.05×10-5 mol·L-1的BaSO4溶液中加入BaSO4固体,SO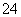 的浓度怎样变化?试通过计算说明。
的浓度怎样变化?试通过计算说明。
查看答案和解析>>
科目:高中化学 来源: 题型:
纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解。为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。对此有下列说法,其中正确的是( )
A.食盐颗粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中,NaCl的物质的量浓度会变大
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇,在工业上应用广泛。工业上制取氯化亚铜的工艺流程如下:
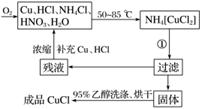
实验药品:铜丝20 g、氯化铵20 g、65%硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为________________________________________________,
用95%乙醇代替蒸馏水洗涤的主要目的是____________________________________________
________________________________________________________________________(写出一条即可)。
(2)工业化生产时,95%乙醇可通过__________的方法回收并循环利用,而NH4Cl、____________(填化学式)可直接循环利用。
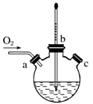
(3)实验室用右图装置制备CuCl。
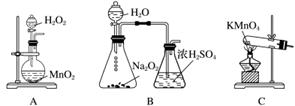
①实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,最宜选择下列装置中的________(填字母)。
②实验开始时,温度计显示反应液温度低于室温,主要原因是________________________________________________________________________
________________________________________________________________________。
电炉加热升温至50 ℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当______________________________时才能停止通入氧
气;待冷却至室温后,再打开瓶塞,沿________(填字母)口倾出棕色反应液于1 000 mL大烧杯中,加水500 mL,即有大量白色沉淀析出。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com