
【题目】尿素(NH2CONH2)是目前含氮量最高的氮肥。国内外主要以NH3和CO2为原料进行合成。主要通过以下二个反应进行:
第一步:2NH3(l)+CO2(g)![]() H2NCOONH4(l) △H1=-117.2kJ·mol-1
H2NCOONH4(l) △H1=-117.2kJ·mol-1
第二步:H2NCOONH4(l)![]() H2O(l)+H2NCONH2(l) △H2=+21.7kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=+21.7kJ·mol-1
请回答:
(1)己知:NH3(l)![]() NH3(g) △H3 = ckJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)
NH3(g) △H3 = ckJ·mol-1。火电厂烟气脱硝所使用的还原剂氨气主要来自于尿素水解。则反应NH2CONH2(l)+H2O(l)![]() 2NH3(g)+CO2(g)的 △H4=_________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________。
2NH3(g)+CO2(g)的 △H4=_________kJ·mol-1 (用含c的式子表示),该反应能在常温下缓慢发生的主要原因是__________________。
(2)①一定条件下,n(NH3)/n(CO2)对NH2COONH4的平衡转化率会产生明显的影响,如图1所示。NH2COONH4的平衡转化率随n(NH3)/n(CO2)增大而上升,试分析其原因:_______________。

②恒温密闭容器中,一定量的NH3和CO2反应合成尿素,第10 min达到平衡。若相同条件下反应1的速率要快于反应2,请在图中画出0~15min内,NH2COONH4的物质的量浓度随时间变化曲线____________。

③下图表示不同条件下,反应:N2(g) +3H2(g)![]() 2NH3(g)的产物浓度随时间的变化曲线。
2NH3(g)的产物浓度随时间的变化曲线。
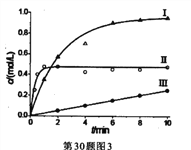
下列有关说法中,正确的是____________。
A.达到平衡时间最快的是II
B.反应约10分钟后,三个反应均己达到平衡
C.I条件下氢气的平衡转化率大于Ⅱ
D.三个反应的平衡常数一定相同
(3)用电化学方法可以实现低温常压合成氨。下图是以含N3-熔融盐为电解质,电解合成氨装置的工作原理示意图。阴极的电极反应是_______________________。

【答案】 95.5+2c 该反应是熵增反应,有利于正向进行 过量的氨气和产物水进一步反应,使反应2的化学平衡正向移动,从而使NH2COONH4的平衡转化率上升 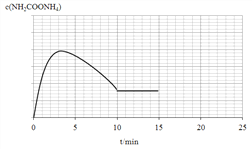 A N2+6e-=2N3-
A N2+6e-=2N3-
【解析】(1)考查热化学反应方程式的计算以及化学反应进行方向的判断,①2NH3(l)+CO2(g) ![]() H2NCOONH4(l),②H2NCOONH4(l)
H2NCOONH4(l),②H2NCOONH4(l) ![]() H2O(l)+H2NCONH2(l),③NH3(l)
H2O(l)+H2NCONH2(l),③NH3(l)![]() NH3(g),根据盖斯定律的计算,2×③-(①+②)得出:△H3=(95.5+2c)kJ·mol-1;此反应是熵增反应,有利于反应正向进行;(2)本题考查勒夏特列原理的应用, ①过量的氨气和产物水进一步反应,使反应2的化学平衡正向移动,从而使NH2COONH4的平衡转化率上升;②相同条件下,反应1的速率快于反应2,因此生成H2NCOONH4曲线比消耗H2NCOONH4曲线陡,在10min时达到平衡,即10min到15min应是平行x轴的直线,即图像是
NH3(g),根据盖斯定律的计算,2×③-(①+②)得出:△H3=(95.5+2c)kJ·mol-1;此反应是熵增反应,有利于反应正向进行;(2)本题考查勒夏特列原理的应用, ①过量的氨气和产物水进一步反应,使反应2的化学平衡正向移动,从而使NH2COONH4的平衡转化率上升;②相同条件下,反应1的速率快于反应2,因此生成H2NCOONH4曲线比消耗H2NCOONH4曲线陡,在10min时达到平衡,即10min到15min应是平行x轴的直线,即图像是 ;③A、根据图像,II首先达到平衡,即II的反应速率最快,首先达到平衡,故A正确;B、反应到10min,II和III达到平衡,I不知道10min后曲线,因此无法判断I是否达到平衡,故B错误;C、题目中没有说明改变的条件,如果I改变的条件是通入H2,虽然平衡向正反应方向进行,但氢气的转化率降低,如果II是增大压强,平衡向正反应方向进行,氢气的转化率增大,故C错误;D、如果II是升高温度,反应速率加快,但化学平衡常数降低,II通入氢气,温度不变,平衡常数不变,则两者平衡常数不相同,故D错误;(3)考查电解原理以及电极反应式的书写,根据装置图电子移动方向,电子从电源的负极出发流向阴极,从阳极流向电源的正极,通N2的一极为阴极,通氢气的一极为阳极,阴极电极反应式为N2+6e-=2N3-。
;③A、根据图像,II首先达到平衡,即II的反应速率最快,首先达到平衡,故A正确;B、反应到10min,II和III达到平衡,I不知道10min后曲线,因此无法判断I是否达到平衡,故B错误;C、题目中没有说明改变的条件,如果I改变的条件是通入H2,虽然平衡向正反应方向进行,但氢气的转化率降低,如果II是增大压强,平衡向正反应方向进行,氢气的转化率增大,故C错误;D、如果II是升高温度,反应速率加快,但化学平衡常数降低,II通入氢气,温度不变,平衡常数不变,则两者平衡常数不相同,故D错误;(3)考查电解原理以及电极反应式的书写,根据装置图电子移动方向,电子从电源的负极出发流向阴极,从阳极流向电源的正极,通N2的一极为阴极,通氢气的一极为阳极,阴极电极反应式为N2+6e-=2N3-。


 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学键与晶体结构说法正确的是( )
A. 两种元素组成的分子中一定只有极性键
B. 离子化合物的熔点一定比共价化合物的高
C. 非金属元素组成的化合物一定是共价化合物
D. 含有阴离子的化合物一定含有阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中使用的金属大多是合金。下列关于合金的描述正确的是
A. 一定是金属熔合形成的 B. 导电性一般高于任一组分金属
C. 生铁和钢的组成成分一定相同 D. 熔点一般低于任一组分的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示水泥的主要成份之一,其中不正确的是( )
A.3CaO·SiO2B.2CaO·SiO2C.3CaO·Al2O3D.2CaO·Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 离子化合物中可能含有共价键 B. 化学键是分子间强烈的作用力
C. H、D、 T表示三种氢元素 D. 共价化合物中各原子都一定满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究难溶性盐X(仅含三种元素)的组成和性质,设计并完成如下实验:

已知:气体甲和气体乙组成元素相同
请回答:
(1)气体乙的摩尔质量是________________。
(2) X的化学式是_________________。
(3)写出X在隔绝空气条件下加热分解的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图1是细胞中3种化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示正常细胞,则甲、乙化合物共有的元素中含量最多的是a
B. 若图1表示细胞完全脱水后化合物含量的扇形图,则甲化合物中含量最多的元素为图2中的b
C. 若图1表示正常细胞,则乙化合物被人体摄入后不能直接吸收
D. 图2中含量最多的元素是a,这与细胞中含量最多的化合物无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以对氨基苯乙酮为原料,按下列路线合成药物中间体E:
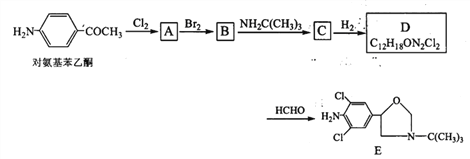
已知:
请回答:
(1)化合物A的分子式是______________。
(2)下列说法正确的是 ____________。
A.对氨基苯乙酮→A的反应条件是光照
B. A→B是发生了加成反应
C.D可以继续和氢气发生反应
D.—定条件下,化合物E与盐酸和氢氧化钠都可以发生反应
(3) D→E的化学方程式是_______________________。
(4) 1-(4-氨基苯基)乙醇也是药物中间体,由对氨基苯乙酮和氢气1:1加成可得。写出同时符合
下列条件的1-(4-氨基苯基)乙醇的所有同分异构体的结构简式_________________ 。
①可以和氯化铁溶液发生显色反应:②1H-NMR谱表明分子中有4种氢原子;
(5)设计以丙酮和一溴甲烷为原料制备NH2C(CH3)3的合成路线(用流程图表示,无机试剂任选)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图。下列说法错误的是( )

A. 若图1表示正常细胞中化合物含量,则A、B共有的元素中在活细胞中含量最多的是图2中的a
B. 若图1表示干细胞中化合物含量,则A中含量最多的元素为图2中的b
C. 若图1表示正常细胞中化合物含量,则B具有多样性,其必含的元素为C、H、O、N
D. 细胞中含量最多的元素是图2中的a,数量最多的也是a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com