
《实验化学》
甲苯氧化法制备苯甲酸的反应原理如下:
 + 2KMnO4
+ 2KMnO4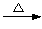
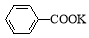 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
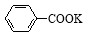 + HCl
+ HCl
 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。

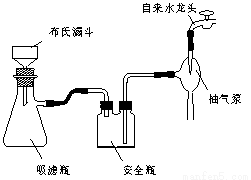
图1回流搅拌装置 图2抽滤装置
⑴实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
⑵如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
⑶在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
⑷纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是( )
A. 放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2
B. 放电时,正极区溶液的pH减小
C. 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D. 充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
燃料电池是燃料(例如CO,H2,CH4等)跟氧气或空气起反应,将此反应的化学能转变为电能的装置,电解质通常是KOH溶液。下列关于甲烷燃料电池的说法不正确的是
A.负极反应式为CH4+10OH--8e=CO32-+7H2O
B.正极反应式为O2+2H2O+4e=4OH-
C.随着不断放电,电解质溶液碱性不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高一下学期期中考试化学试卷(解析版) 题型:选择题
用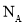 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
A.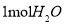 中含有的原子数为
中含有的原子数为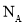
B.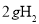 中含有的氢原子数为2
中含有的氢原子数为2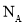
C.常温常压下,11.2L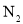 中含有的分子数为0.5
中含有的分子数为0.5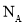
D.1L0.1mol·L-1NaNO3溶液中含有的钠离子数为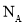
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:填空题
(15分)5-氯-2,3-二氢-1-茚酮是合成新农药茚虫威的重要中间体。
已知: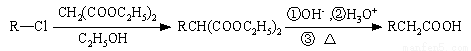
以化合物A(分子式为C7H7Cl)为原料合成5-氯-2,3-二氢-1-茚酮(化合物F)工艺流程如下:
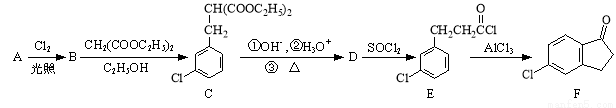
⑴写出反应A→B的化学方程式: 。
⑵化合物F中含氧官能团的名称为 ,反应B→C的类型为 。
⑶某化合物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢。写出该化合物的结构简式: (任写一种)。
⑷E→F的转化中,会产生一种与F互为同分异构体的副产物,其结构简式为 。
⑸根据已有知识并结合相关信息,写出以化合物F和CH2(COOC2H5)2为有机反应原料制备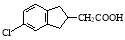 的合成路线流程图(注明反应条件)。合成路线流程图示例如下:
的合成路线流程图(注明反应条件)。合成路线流程图示例如下:
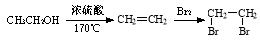
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:选择题
短周期元素原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期。下列推测正确的是
A.元素Y的最高化合价为+7
B.三种元素的原子半径rZ>rY>rX
C. Z的单质比Y的单质更易与H2反应
D.化合物X2Z2中阴阳离子数之比为1: 2
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省2013-2014学年高三模拟考试化学试卷(解析版) 题型:选择题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南京市雨花区高一下学期期末考试化学试卷(解析版) 题型:填空题
(12分)I. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为 。
(2)下列物质中,不可以通过乙烯加成反应得到的是 (填序号)。
A.CH3CH3B.CH3CHCl2
C.CH3CH2OHD.CH3CH2Br
(3)已知 2CH3CHO+O2 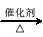 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
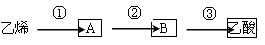
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 ,反应类型是 。
II. 在实验室可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇、乙酸分子中官能团的名称分别是 、 。
(2)试管a中发生反应的化学方程式为 ,反应类型是 。
(3)浓H2SO4的作用是: 。
(4)反应开始前,试管b中盛放的溶液是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com