
分析 (1)依据铝热反应原理,三氧化二钒与铝反应生成氧化铝和钒;
(2)铝与氧气反应生成氧化铝的熔点高;铝与水反应生成氢氧化铝和氢气;铝汞齐的化学性质变得“活泼”的原因可能汞做溶剂,隔绝空气使铝表面不容易形成致密氧化膜;
(3)氯化铝与氟化铵反应生成六氟合铝酸铵和氯化铵;氟化铵水解生成氢氟酸,氢氟酸能够与玻璃中二氧化硅反应;
(4)根据题干信息,反应物为:铝、NO3-、OH-,生成物为:N2、H2O、碱性条件下铝参加反应生成物还有AlO2-,根据电子守恒和原子守恒书写方程式;
依据Al(OH)3?AlO2-+H++H2O K=1.0×10-13,结合水中AlO2-浓度降到1.0×10-6mol•L-1,计算氢离子浓度;依据Ksp[Al(OH)3]=1.3×10-33,计算铝离子浓度.
解答 解:(1)三氧化二钒与铝反应生成氧化铝和钒,化学方程式:3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$ 6V+5Al2O3,
故答案为:3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$ 6V+5Al2O3;
(2)铝与氧气反应生成氧化铝的熔点高,铝表面很快形成致密氧化膜,其熔点高于铝,则铝箔在酒精灯火焰上加热熔化但不滴落;铝与水反应生成氢氧化铝和氢气,化学方程式:2Al+6H2O=2Al(OH)3+3H2↑;
故答案为:铝表面很快形成致密氧化膜,其熔点高于铝;2Al+6H2O=2Al(OH)3+3H2↑;表面不容易形成致密氧化膜;
(3)氯化铝与氟化铵反应生成六氟合铝酸铵和氯化铵,方程式:AlCl3+NH4F=(NH4)3AlF6+3NH4Cl;氟化铵中的氟离子水解生成氢氟酸,氢氟酸能够与玻璃中二氧化硅反应,对玻璃有强烈的腐蚀性而对塑料则无腐蚀性,所以该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质;
故答案为:AlCl3+NH4F=(NH4)3AlF6+3NH4Cl;氟化铵中的氟离子水解生成氢氟酸,氢氟酸能够与玻璃中二氧化硅反应,对玻璃有强烈的腐蚀性而对塑料则无腐蚀性;
(4)根据题干信息,反应物为:铝、NO3-、OH-,生成物为:N2、H2O、碱性条件下铝参加反应生成物还有AlO2-,反应中Al→AlO2-,Al元素化合价由0价升高为+3价,共升高3价,NO3-→N2↑,氮元素化合价由+5价降低为0价,共降低10价,化合价升降最小公倍数为30,依据原子个数守恒、电荷守恒反应的离子方程式:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;水中AlO2-浓度降到1.0×10-6mol•L-1,依据Al(OH)3?AlO2-+H++H2O K=1.0×10-13,则C(H+)=$\frac{1.0×1{0}^{-13}}{1.0×1{0}^{-6}}$=10-7(mol/L);
pH=7,C(OH-)=10-7mol/L,:25℃时,Ksp[Al(OH)3]=1.3×10-33,则C(Al3+)=$\frac{1.3×1{0}^{-33}}{(1{0}^{-7})^{3}}$=1.3×10-12mol•L-1;
故答案为:10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O;7;1.3×10-12mol•L-1.
点评 本题为综合题,考查了金属的冶炼、离子方程式、方程式的书写、有关平衡常数的计算,熟悉铝及其化合物性质是解题关键,注意化学平衡常数的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金具备金属的特性 | |
| B. | 合金的硬度一般比其组成成分金属的硬度大 | |
| C. | 合金的熔点一般比其组成成分的熔点低 | |
| D. | 合金只能由两种或两种以上的金属组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
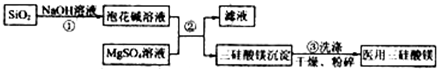
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
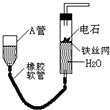 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | CuSO4 | C. | H2SO4 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl2不存在同分异构体是甲烷正四面体结构的理由之一 | |
| B. | 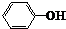 和 和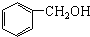 互为同系物 互为同系物 | |
| C. |  的系统命名的名称是1,2-二溴-2-环己烯 的系统命名的名称是1,2-二溴-2-环己烯 | |
| D. | 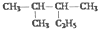 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com