
现用质量分数为98%、密度为18.4g·cm-3的浓H2SO4来配制400 mL 0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥容量瓶 ⑦托盘天平 。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时还欠缺的仪器是 。
(2)经计算,需量取浓H2SO4的体积为mL。
(3)请用文字叙述实验过程中的定容操作。
(4)在配制过程中,下列操作中,能引起误差偏高的有(填代号)。
A.定容时,俯视标线
B.稀释后的H2SO4溶液未等冷却至室温就转移到容量瓶中
C.摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
D.转移前,容量瓶中含有少量蒸馏水
(5)从上述容量瓶中移取25.00mL的稀硫酸溶液于100mL的容量瓶,加水稀释至刻度线。请问所得溶液中c(H+)= 。
科目:高中化学 来源:2017届云南曲靖市高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关物质的分类或归类,正确的一组是
①液氨、硫磺、干冰、碘化银均为化合物
②氢氟酸、盐酸、水玻璃、氨水均为混合物
③胆矾、明矾、小苏打、苏打均为电解质
④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤Na2O2、Na2CO3、NaHCO3、Na2SiO3均为钠盐
A.①②
B.②③
C.③④
D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2017届山东师范大学附属中学高三上第二次模拟考试化学试卷(解析版) 题型:选择题
短周期元素W、X、Y和Z的原子序数依次增大。W原子是半径最小的原子,X原子的最外层电子数是内层电子数的3倍,元素Y与W同主族,Z原子的最外层电子数是其电子层数的2倍。下列说法正确的是
A. 四种元素在自然界中都有游离态
B. X分别与W、Y、Z都可组成具有漂白性的物质,且它们的漂白原理相同
C. 元素W、Y的氯化物中,各原子(或离子)均满足8电子的稳定结构
D. 元素W可与元素X形成一种既含极性键又含非极性键的共价化合物
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
下列各组物质的无色溶液,不用其他试剂即可鉴别的是
①KOHNa2SO4AlCl3②Na2CO3Ba(OH)2H2SO4③HClNa[Al(OH)4]NaHSO4④Ca(OH)2Na2CO3BaCl2
A.①②
B.②③
C.①③④
D.①②④
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三10月阶段检测化学试卷(解析版) 题型:选择题
用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭。发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又会作响并鼓起来,下列说法正确的是
A.导致易拉罐变瘪的离子反应是CO2+OH-=HCO3-
B.导致易拉罐又鼓起来的反应是:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C.上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性
D.若将CO2换为NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省瓦房店市高一上10月月考化学试卷(解析版) 题型:选择题
在下列溶液中Cl- 的物质的量浓度最大 的是:
的是:
A.0.5L 0.2mol/L NaCl溶液 B.100mL 0.1mol/L MgCl2溶液
C.1L 0.1mol/L AlCl3溶液 D.1L 0.4mol/L KClO3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省瓦房店市高一上10月月考化学试卷(解析版) 题型:选择题
下列实验过程中对异常情况的原因分析,没有依据的是:
选项 | 异常情况 | 可能的原因 |
A | 蒸发结晶时,蒸发皿破裂 | 将溶液蒸干,或酒精灯灯芯碰到蒸发皿底部 |
B | 分液时,分液漏斗中的液体很难滴下 | 没有打开分液漏斗颈上的玻璃塞或塞上的凹槽与漏斗上小孔没有对齐 |
C | 萃取时,振荡溶液,静置不分层 | 萃取剂加的太多 |
D | 蒸馏时,发现冷凝管破裂 | 没有通冷凝水或先加热后通冷凝水 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省瓦房店市高二上10月月考化学试卷(解析版) 题型:选择题
下列各烃分别与H2完全加成,不能生成2,2,3—三甲基戊烷的是
A.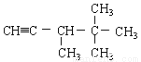
B.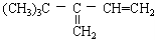
C.CH2=CHC(CH3)2CH(CH3)2
D.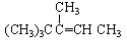
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省宜春市高二上月考一化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com