
| n |
| V |
| 消耗量 |
| 起始量 |
| △c |
| △t |
| 消耗量 |
| 起始量 |
| 0.24mol/L |
| 0.3mol/L |
| △c |
| △t |
| 0.24mol/L |
| 2min |


科目:高中化学 来源: 题型:
| A、X或Y均能使湿润的淀粉碘化钾试纸变蓝 |
| B、1molY或Z与足量水完全反应时,均转移1mol电子 |
| C、Z为离子化合物,但含有共价键,阴、阳离子个数比为1:2 |
| D、X和Y均能用向上排空气法和排水法收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:
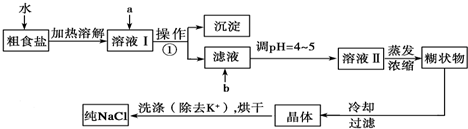
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
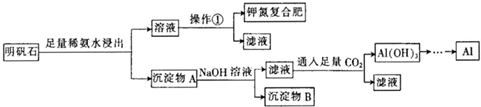
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离、提纯----确定分子式-----确定实验式----确定结构式 |
| B、分离、提纯----确定实验式-----确定分子式-----确定结构式 |
| C、分离、提纯----确定结构式-----确定实验式-----确定分子式 |
| D、确定分子式-----确定实验式----确定结构式-----分离、提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“两者同食”发生的反应中维生素C作还原剂 |
| B、五价砷在维生素C作用下发生了还原反应 |
| C、河虾中含有的五价砷,没有毒性 |
| D、可以推测砒霜中所含的砷元素化合价为+5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com