
测定有机化合物中碳和氢组成常用燃烧分析法,下图是德国化学家李比希测定烃类有机物组成的装置,氧化铜作催化剂,在750 ℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和高氯酸镁[Mg(ClO4)2]的吸收管分别吸收CO2和H2O。
试回答下列问题:
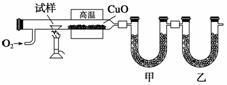
(1)甲装置中盛放的是__________,甲、乙中的吸收剂能否颠倒?说明理由:
________________________________________________________________________。
(2)实验开始时,要先通入氧气一会儿,然后再加热。为什么?
(3)若测得甲装置增重a g,乙装置增重b g,试求出烃中碳、氢原子个数比为________________。
(4)若已知试样是纯净物,某次测定时,测出碳、氢原子个数比为N(C)∶N(H)=11∶23,能否确定其为何种烃?________(填“能”或“不能”);若能,写出其分子式________(若不能,此空不必回答)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
常见元素A、B、M组成的四种物质发生反应:甲+乙 丙+丁,其中甲由A和M组成,乙由B和M组成,丙只含M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为 ;生成标准状况下5.6L丙转移移电子数为 ;常温下丁溶液pH 7,用离子方程式解释 。
(2)若丁为能使品红褪色的无色气体,丙为常见紫红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。则:
①A在周期表中位置为
②将丁通至FeCl3溶液中的现象为
离子反应方程式为
③正确书写上述生成丙的化学方程式
④向MCl2的溶液中通入丁,可观察到白色的MC1沉淀,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用钠融法可定性确定有机物中是否存在氯、溴、硫、氮等元素。下列有关有机物与足量钠反应,各元素的转化结果正确的是( )
A.碳元素转化为NaCN
B.氯元素转化为高氯酸钠
C.溴元素转化为溴化钠
D.硫元素转化为硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中碳原子的个数最多为( )
A.4 B.5 C.6 D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
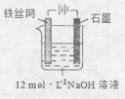
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池装置如右图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂。下列叙述正确的是
A.原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大
B.此电池工作原理与硅太阳能电池工作原理相同
C.Fe为正极,石墨上发生的反应为:2H++2e-=H2↑
D.若装置中的盐桥用铁丝代替,电流表指针无偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
化学已经渗透到人类生活的各个方面,下列说法不正确的是
A. 食盐可作氯碱工业的原料
B. 碘酒是指单质碘的乙醇溶液
C. 大量使用化肥和农药,以提高农作物产量,符合绿色化学的原则
D. 低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如下图所示。(部分生成物和反应条件已略去)
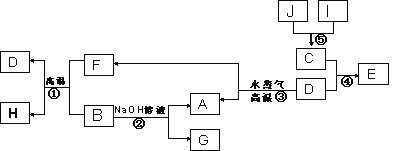
请回答下列问题:
(1) 写出组成物质D的元素在周期表中的位置:___________________。
(2) ①写出反应①的化学方程式:______________________________。
②由E的饱和溶液可以制得胶体,用化学方程式表示该过程的原理是_______________。
③写出反应②的离子方程式_________________________________。
(3) 已知G的水溶液显碱性,其原因是(用离子方程式表示)_________。
(4) J在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com