
| ||
| 0.05mol |
| 0.5L |
| ||


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、石墨电极上产生氢气 |
| B、铜电极发生还原反应 |
| C、铜电极接直流电源的负极 |
| D、当有0.1mol电子转移时,有0.1molCu2O生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校化学研究性学习小组以铜为电极电解饱和食盐水,探究过程如下:
某校化学研究性学习小组以铜为电极电解饱和食盐水,探究过程如下:| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸 | 砖红色沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸 | 砖红色沉淀转变为紫红色不溶物,溶液呈蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色 | 氯化亚铜 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
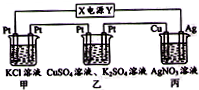
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com