
| 1 |
| 3 |
| n |
| V |


科目:高中化学 来源: 题型:
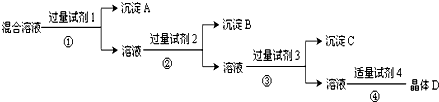
| A、氯化钡溶液 硝酸银溶液 硝酸溶液 |
| B、氯化钡溶液 硝酸溶液 硝酸银溶液 |
| C、NaOH 溶液 硝酸银溶液 硝酸溶液 |
| D、硝酸银溶液 硝酸钡溶液 硝酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10- |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-1 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
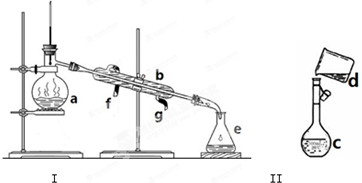 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
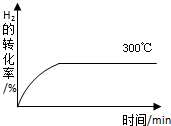 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) 下表为不同温度下的平衡常数(K)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) 下表为不同温度下的平衡常数(K)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:
如图为实验室某浓硫酸试剂瓶上的标签,回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量新制的氯水滴到蓝色的石蕊试纸上,试纸先变红,说明氯水中含有H+ |
| B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D、氯水能使有色花瓣褪色,说明氯水中含有Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
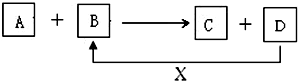 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系(图中反应条件略去)
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系(图中反应条件略去)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com