
【题目】将一定量的X加入某密闭容器中,发生反应:2X(g)![]() 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是()。
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是()。
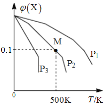
A. 升高温度,该反应平衡常数K减小
B. 压强大小有P3>P2>P1
C. 平衡后加入高效催化剂使平均摩尔质量增大
D. 在该条件下M点X平衡转化率为9/11
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示:
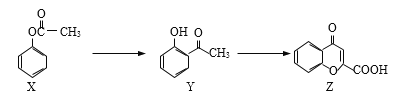
下列有关叙述正确的是
A. 三种物质中都含有羰基
B. 等物质的量的Y、Z能和含有等物质的量的NaOH的溶液反应
C. 可用NaHCO3溶液鉴别三种物质
D. 1 mol Z跟足量O2反应,最多消耗10 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目小于0.1NA
B.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
C.1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA
D.常温常压下,7.0g乙烯与丙烯的混合物中含有的电子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表诞生150周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
IA | 0 | |||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ||||||||
(1)元素①~⑧中,金属性最强的是________(填元素符号。
(2)中国青年化学家姜雪峰被国际组织推选为“元素⑦代言人”,元素⑦的原子结构示意图是_________,其氢化物的电子式是_________。
(3)比较元素②、③的最高价氧化物对应水化物的酸性:______>______(填化学式)。说明你判断的理由:_________。
(4)主族元素砷(As)的部分信息如图所示。

①砷(As)在周期表中的位置是______。
②下列说法正确的是_______(填序号)。
a.砷元素的最高化合价为+4
b.推测砷有多种氧化物
c.③的气态氢化物的还原性大于砷的气态氢化物的还原性
(5)某小组同学设计实验比较VIIA元素的非金属性:Cl>Br>I。已知:常温下浓盐酸与高锰酸钾反应生成氯气。
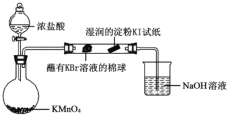
打开分液漏斗的活塞,烧瓶中产生黄绿色气体,蘸有KBr溶液的棉球变为橙红色,湿润的淀粉KI试纸变蓝,据此现象能否说明非金属性:Br >I,并说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)该实验探究的是_________________________________因素对化学反应速率的影响。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________ mol·L-1(假设混合溶液的体积为50 mL)。
(3)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②_______________________________
Ⅱ:当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为___________________________________
(2)在恒温恒容密闭容器中,判断上述反应达到平衡状态的依据是________________
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
选项 | 实验目的 | 实验过程 |
A | 制备Fe(OH)胶体 | 将NaOH浓溶液滴加到饱和FeCl溶液中 |
B | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L的NaOH溶液250mL | 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立刻转移至250 mL容量瓶中定容 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取 1LFeCl3 溶液腐蚀铜板制作电路板,反应后在此残留液中慢慢加入铁粉,溶液中 Fe2+的浓度变化如图所示(加入固体引起的体积变化忽略不计),下列说法错误的是
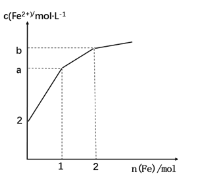
A.当n(Fe)=0.5mol 时,发生的离子反应为 Fe+2Fe3+=3Fe2+
B.当 n(Fe)=1.5mol 时,溶液中发生的总反应离子方程式为4Fe3++Cu2++3Fe=7Fe2++Cu
C.当n(Fe)=1mol 时,溶液中 c(Fe2+)=5 mol·L-1
D.腐蚀之前原溶液中n(Fe3+)=4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅、二氧化铅、氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质],下列说法中不正确的是( )
2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质],下列说法中不正确的是( )
A. 放电时,溶液中的BF4-向负极移动
B. 放电时,转移1mol电子时正极减少的质量为119.5g
C. 充电时,阳极附近溶液的酸性减弱
D. 充电时,阴极的电极反应式为Pb2++2e-═Pb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com