
| A.N2和H2在点燃或光照条件下可合成氨 |
| B.氨水显酸性 |
| C.氨气遇到浓盐酸会发生反应产生白烟 |
| D.由氨制取硝酸过程中,氮元素被还原 |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源:不详 题型:单选题
| A.甲醇 | B.汽油 | C.柴油 | D.重油 |
| E.重油 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.现在人们使用的能源正向多元化发展,许多新能源不断被开发利用,其中氢能源和太阳能均属于清洁能源 |
| B.已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol |
| C.反应热的大小与反应物和生成物的键能无关 |
| D.1molNaOH分别和1molCH3COOH、1molHNO3反应,放出的热量:CH3COOH=HNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.寻求氮气新来源 |
| B.研制低温下活性较大的催化剂 |
| C.研制500℃左右活性较大的催化剂 |
| D.研制耐高温、高压的新材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
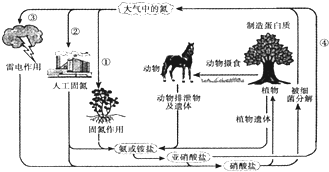
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸厂不应建在人口稠密的居民区和环保要求高的地区 |
| B.硫酸厂靠近原料产地比靠近硫酸消费中心更为有利 |
| C.硫酸厂生产过程中的污水,含有硫酸等杂质,可用石灰乳中和处理 |
| D.可利用硫酸厂生产过程中产生的“废热”来供热和发电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
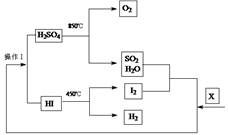
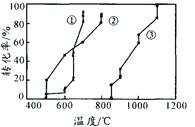
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com