
【题目】在体积为2L的真空密闭容器中加人1 mol CaCO3,发生反应:CaCO3(s) ![]() CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.
CaO(s)+CO2(g)。测得二氧化碳的物质的量浓度随温度的变化如图所示。图中曲线A表示CO2的平衡浓度与温度的关系;B是不同温度下,反应经过相同的时间时,CO2物质的量浓度的变化曲线.

请回答下列问题:
(1)已知:①CaO(s)+SO2(g)==CaSO3(s) △H1=-402kJ·mol-1
②2CaCO3(s)+2SO2(g)+O2(g)==2CaSO4(s)+2CO2(g) △H2=-2762kJ·mol-1
③2CaSO3(s)+O2(g)==2CaSO4(s) △H3=-2315kJ·mol-1
则:CaCO3(s)==CaO(s)+CO2(g)的△H=____kJ·mol-1
(2)①温度为T5℃时,反应CaCO3(s) ![]() CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
CaO(s)十CO2(g)耗时20s达到平衡,则20s内该反应的反应速率为v(CO2)=____;反应的平衡常数为____mol·L-1。
②如果该反应的平衡常数K值变大,该反应____(选填编号)。
A.一定向逆反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向正反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则达到平衡时CaCO3的质量____(填“增大”、“减小”或“不变”)。
(4)在T5℃下,反应达到平衡状态后,再压缩容器为1L,重新达到平衡时,CO2的浓度____(填“增大”、“减小”或“不变”)
(5)随着温度的升高,曲线B向曲线A逼近的原因是____。
【答案】+178.5 0.01mol/(L·s) 0.2 BC 增大 不变 温度升高,化学反应速率加快,达平衡的时间缩短
【解析】
(1)根据盖斯定律,![]() -①-
-①-![]() ,CaCO3(s)==CaO(s)+CO2(g) △H=-1381+402+1157.5=+178.5kJ/mol;
,CaCO3(s)==CaO(s)+CO2(g) △H=-1381+402+1157.5=+178.5kJ/mol;
(2)①T5℃时,平衡时二氧化碳的浓度为0.2mol/L,反应前二氧化碳的物质的量为0,v(CO2)= 0.2mol/L/20s=0.01mol/(L·s);K=c(CO2)=0.2,K增大,则平衡正向移动,
A.平衡逆向移动,与题意不符,A错误;
B. 正反应速率先增大后减小,二氧化碳的浓度增大,B正确;
C. 一定向正反应方向移动,C正确;
D. 逆反应速率先减小后增大,平衡逆向移动,二氧化碳浓度减小,D错误;
(3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则二氧化碳的浓度增大,则KQ增大,平衡逆向移动,则碳酸钙的质量增加,答案为:增大;
(4)在T5℃下,反应达到平衡状态后,温度不变,化学平衡常数不变,则CO2的浓度不变;
(5)根据温度对反应速率的影响可知,随着温度升高,反应速率加快,达到平衡所需要的时间变短,所以曲线B向曲线A逼近;
(1)根据盖斯定律,![]() -①-
-①-![]() ,CaCO3(s)==CaO(s)+CO2(g) △H=-1381+402+1157.5=+178.5kJ/mol;
,CaCO3(s)==CaO(s)+CO2(g) △H=-1381+402+1157.5=+178.5kJ/mol;
(2)①T5℃时,平衡时二氧化碳的浓度为0.2mol/L,反应前二氧化碳的物质的量为0,v(CO2)= 0.2mol/L/20s=0.01mol/(L·s);K=c(CO2)=0.2,K增大,则平衡正向移动,
A.平衡逆向移动,与题意不符,A错误;
B. 正反应速率先增大后减小,二氧化碳的浓度增大,B正确;
C. 一定向正反应方向移动,C正确;
D. 逆反应速率先减小后增大,平衡逆向移动,二氧化碳浓度减小,D错误;
答案为:0.01mol/(L·s);0.2;BC;
(3)在T5℃下,维持温度和容器体积不变,充入CO2气体,则二氧化碳的浓度增大,则KQ增大,平衡逆向移动,则碳酸钙的质量增加,答案为:增大;
(4)在T5℃下,反应达到平衡状态后,温度不变,化学平衡常数不变,则CO2的浓度不变;
(5)根据温度对反应速率的影响可知,随着温度升高,反应速率加快,达到平衡所需要的时间变短,所以曲线B向曲线A逼近,答案为:温度升高,化学反应速率加快,达平衡的时间缩短;


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子B.H2O与D2O互称同素异形体
C.1H与D互称同位素D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素碲(Te)是当今高新技术新材料的主要成分之一。已知:TeO2是两性氧化物。工业上常用“铜阳极泥”(主要含Cu2Te,还含少量Ag、Au)为原料制备单质碲,其工艺流程如图所示。

回答下列问题:
(1)碲(Te)位于元素周期表第_________周期第ⅥA族;下列有关确的性质的叙述错误的是______。
A.碲的单质在常温下是固态 B.碲的常见化合价有-2、+4、+6
C.碲可能用作半导体材料 D.碲的氢化物H2Te很稳定
(2)实验室中“操作I”的名称是________,下列仪器与该实验操作无关的是________。
A.长颈漏斗 B.烧杯 C.锥形瓶 D.玻璃棒 E.容量瓶
(3)在“加压硫酸浸出”过程中,每消耗1mol Cu2Te反应生成TeOSO4,转移的电子数为________mol;“含硫浸出液”的溶质主要成分除TeOSO4外,还含有________(写化学式)。
(4)“电解沉积除铜”时,将“含酶浸出液”置于电解槽中,铜、确沉淀的关系如图所示。电解初始阶段阴极的电极反应式是__________。

(5)①向“含确硫酸铜溶液”中通入SO2还原TeOSO4生成磅的化学方程式为__________。
②上述反应在加入少量NaCl后,反应速率大幅度加快,则NaCl的主要作用为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
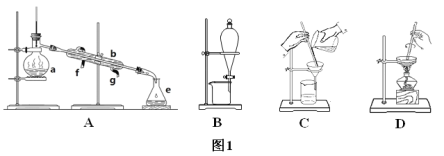
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置____。
(2)从碘水中分离出I2选择装置_____,该分离方法的名称为____。
(3)装置A中仪器a的名称是_____,进水的方向是____。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:

(1)粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)______。
a.⑤②③①④⑥⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚甲基丙烯酸羟乙酯(HEMA)是一种隐形眼镜的仿生材料,其单体的结构简式为:

回答下列问题:
(1)写出合成路线中C4H8的结构简式____________,写出它的系统命名法名称___________。
(2)D分子中含有的官能团名称为___________。
(3)反应②的试剂及条件为___________,反应⑤的反应类型为___________。
(4)写出反应⑥的化学方程式___________。
(5)写出由单体合成聚甲基丙烯酸羟乙酯(HEMA)的化学方程式___________。
(6)写出同时符合下列条件的C的同分异构体:___________。
①能与NaHCO3溶液反应放出气体 ②核磁共振氢谱中有3组吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.SO2能使KMnO4水溶液迅速褪色
B.可以用澄清石灰水鉴别SO2和CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.SO2可用于漂白食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知强酸与强碱在稀溶液里发生中和反应生成1molH2O时放出57.3kJ热量。用500mL 0.6mol/L 的稀硫酸跟足量的NaOH溶液反应,放出的热量是( )
A. 68.76kJB. 57.3kJC. 34.38kJD. 17.19kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的是( )
A. NH4 键角等于109.28°
B. SnBr2 键角大于 120°
C. SF6 中有 6 对完全相同的成键电子对
D. SiF4 和 SO42 的中心原子均为sp3杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com