
Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:
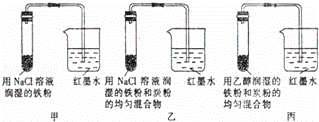
(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是 .
(2)通过甲、乙装置的对比说明钢铁中碳的含量越 (填“高”或“低”)钢铁越易腐蚀.
(3)乙装置中发生电化学腐蚀时正极的电极反应式为 .
Ⅱ.利用化学反应:2FeCl3+Cu═2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池.可供选择的电极材料:铁棒、铜棒、石墨棒.可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液.
请填写下列空白:
(1)选择 作正极材料, 作负极材料;选择 作电解质溶液.
(2)写出有关的电极反应式:正极: ;负极: .
考点:
探究原电池及其工作原理.
专题:
电化学专题.
分析:
Ⅰ.(1)乙形成了原电池,丙浸没在非电解质溶液中,故腐蚀速率乙>甲>丙;
(2)含碳量越高,容易形成原电池,所以越易腐蚀;
(3)乙发生吸氧腐蚀,发生电化学腐蚀时正极氧气得到电子生成氢氧根离子;
Ⅱ.(1)根据反应“2FeCl3+Cu=2FeCl2+CuCl2”可知,反应中铜失电子而被氧化,应为原电池负极,正极应为活泼性比铜弱的金属或导电的非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3;
(2)正极铁离子得到电子生成亚铁离子,负极铜失去电子生成铜离子,据此写出电极反应即可.
解答:
解:Ⅰ.(1)甲为铁粉在氯化钠溶液中的腐蚀,乙为铁粉与碳形成原电池的腐蚀,而丙的腐蚀没有电解质溶液,所以腐蚀的速率大小为:乙>甲>丙,故过一段时间后液面最高的是乙,
故答案为:乙;
(2)甲中为铁粉,乙为铁粉与碳粉的混合物,甲的腐蚀速率小于乙的,通过甲、乙装置的对比说明钢铁中碳的含量越高,钢铁越易腐蚀,
故答案为:高;
(3)乙装置中发生电化学腐蚀时,分解铁失去电子,正极氧气得到电子生成氢氧根离子,正极的电极反应式为:O2+4e﹣+2H2O═4OH﹣,
故答案为:O2+4e﹣+2H2O═4OH﹣;
Ⅱ.(1)由反应“2FeCl3+Cu=2FeCl2+CuCl2”可知,反应中铜失电子而被氧化,应为原电池负极,正极应为活泼性比铜弱的金属或导电的非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,
故答案为:石墨;铜;FeCl3溶液;
(2)负极上铜失电子发生氧化反应,正极上铁离子得电子发生还原反应,其负极反应式为Cu﹣2e﹣=Cu2+,正极为2Fe3++2e﹣=2Fe2+,
故答案为:2Fe3++2e﹣=2Fe2+;Cu﹣2e﹣=Cu2+.
点评:
本题考查了金属的电化学腐蚀、原电池工作原理,题目难度中等,注意掌握原电池工作原理,明确金属腐蚀快慢比较方法:(1)电解原理引起的阳极腐蚀>原电池原理引起的负极腐蚀>化学腐蚀>有防护措施的腐蚀;(2)对同一种金属,腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液;活泼性不同的两种金属,活泼性差别越大,腐蚀越快;(3)对同一种电解质溶液,电解质溶液浓度越大,腐蚀越快;(4)由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式;另外,只有在金属活动性顺序表中位于氢前面的金属才可能发生析氢腐蚀,而位于氢之后的金属腐蚀只能是吸氧腐蚀.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
对物质进行分类是一种简单、有效的科学方法.下列各组物质的分类都正确的是()
A. 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B. NO2(酸性氧化物)、CH3CHO(有机物)、CO(无机物)、CH3COOCH3(酯)
C. HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D. 液氨(氢化物)、NH4C1(铵盐)、HNO3(含氧酸)、NaOH(强电解质)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示从烷烃A开始的一系列反应(部分条件、试剂被省略),且化合物B中仅有3个碳原子、1个溴原子、2种氢原子.回答下列问题:
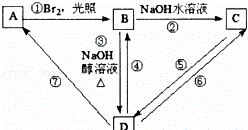
(1)属于取代反应的有 .(填框图中序号,下同),属于加成反应的有 ,属于消去反应的有 .
写出下列反应的化学方程式:
(2)B→D .
(3)在铜存在的条件下C被催化氧化: ;
(4)D在一定条件下生成高分子化合物: .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
|
| A. | X与Y形成化合物时,X可以显负价,Y显正价 |
|
| B. | 第一电离能可能Y小于X |
|
| C. | 最高价含氧酸的酸性:X对应的酸的酸性弱于Y对应的酸的酸性 |
|
| D. | 气态氢化物的稳定性:HmY小于HnX |
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因.假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,则这种纳米颗粒的分子式为( )( 镁原子○位于顶点和上下两个面心,硼原子●位于内部 )

|
| A. | MgB | B. | Mg3B6 | C. | Mg5B12 | D. | Mg14B6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对2SO2+O2⇌2SO3的反应.如果在密闭容器中进行,下列说法错误的是( )
|
| A. | 使用催化剂是为了加快反应速率,提高生产效率 |
|
| B. | 在上述条件下,SO2不可能100%地转化为SO3 |
|
| C. | 达到平衡时,SO2的浓度与SO3的浓度相等 |
|
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
|
| A. | 电池工作时,锌失去电子 |
|
| B. | MnO2为该电池的负极 |
|
| C. | 正极反应为:Zn﹣2e﹣=Zn2+ |
|
| D. | 该电池放电时化学能转换为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com