
| A. | 0.032mol•L-1 | B. | 0.036mol•L-1 | C. | 0.04mol•L-1 | D. | 0.045mol•L-1 |
分析 某状况下,3.2g O2的体积为2.5L,该条件下的气体摩尔体积为:$\frac{2.5L}{\frac{3.2g}{32g/mol}}$=25L/mol;
发生反应:4NO2+O2+2H2O=4HNO3,气体完全反应,所得溶液的体积等于烧瓶的容积等于混合气体的体积,设体积为1L,计算二氧化氮的体积,再根据n=$\frac{V}{{V}_{m}}$计算二氧化氮的物质的量,计算硝酸的物质的量,最后根据c=$\frac{n}{V}$计算所得硝酸溶液的浓度.
解答 解:某状况下,3.2g O2的体积为2.5L,该条件下的气体摩尔体积为:$\frac{2.5L}{\frac{3.2g}{32g/mol}}$=25L/mol,
设混合气体的总体积为1L,则二氧化氮的体积为$\frac{4}{5}$L,物质的量为:$\frac{\frac{4}{5}L}{25L/mol}$=$\frac{4}{125}$mol=0.032mol,由4NO2+O2+2H2O=4HNO3可知n(HNO3)=0.032mol,气体完全反应,所得溶液的体积等于烧瓶的容积等于混合气体的体积,
故所得硝酸溶液的物质的量浓度为:c(HNO3)=$\frac{0.032mol}{1L}$=0.032mol•L-1,
故选A.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算该条件下气体摩尔体积的数值为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
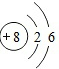 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
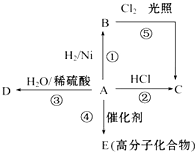 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | HClO+H2O?H3O++ClO- | ||
| C. | NaHCO3?Na++HCO3- | D. | 在熔化时NaHSO4═Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入过量的SO2:SO2+20H-═SO32-+H20 | |
| B. | Na2O2和H2O反应:Na2O2+H2O═2Na++20H-+02↑ | |
| C. | Cl2和H2O反应:Cl2+H20═2H++Cl-+Cl0- | |
| D. | SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
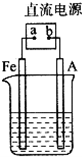 某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:
某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
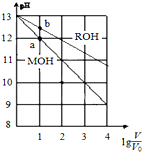 pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
pH相同、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | MOH的物质的量浓度大于ROH | |
| B. | 水的电离程度:b点大于a点 | |
| C. | 两溶液在稀释过程中,溶液中各离子浓度都减少 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com