
|
实验室有NaI、Na3PO4、NaNO3三瓶试剂,因失落标签,在一一加以鉴别时,应选用的试剂组是 | |
| [ ] | |
A. |
AgNO3溶液,稀硝酸 |
B. |
AgNO3溶液,稀硫酸 |
C. |
AgNO3溶液,浓硝酸 |
D. |
AgNO3溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
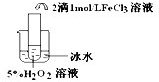
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据元素分析结果推测该粉末为纯净物 | B、将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是K2SO4 | C、将粉末加入盐酸中,产生气泡,证明原粉末是K2SO3 | D、将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.AgNO3溶液,稀硝酸 B.AgNO3溶液,稀硫酸
C.AgNO3溶液,浓硝酸 D.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分。利用已学知识对下列实验进行分析并填空:
Ⅰ.
| 实验目的 |
| ||
| 实验 |
|
|
|
| 实验结论 | 结论: FeCl3在实验中的作用为: | ||
| 反应方程式 |
| ||
Ⅱ.
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中,振荡后加入CCl4,振荡、静置 | (1)溶液分层,上层几乎无色,下层为橙色。 (2) | (1) (2) |
| 2.将少量溴水加入盛有NaI溶液的试管中,振荡后加入少量CCl4,振荡、静置 | (3) | |
| 实验结论并从原子结构上解释原因 |
| |
Ⅲ.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
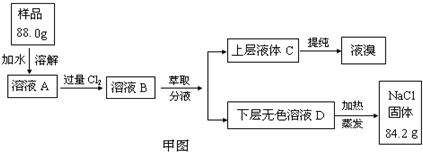
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从下方乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品。
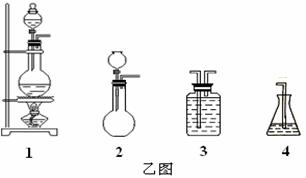

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为 (填选项字母)
A. 碘水 B. 淀粉碘化钾溶液
C. 新制氯水和四氯化碳 D. 食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A. 四氯化碳 B. 水 C. 乙醇 D. 苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为 %
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com