
【题目】由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐Na4S2O3中加入足量稀硫酸,发生反应:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A. Na4S2O3的水溶液显碱性
B.1mol Na4S2O3中共含离子数为5NA
C.上述反应中,每产生3molS,转移电子的物质的量为6mol
D.CaOCl2也可称为混盐,向CaOCl2中加入足量稀硫酸会有Cl2产生
【答案】AD
【解析】
混盐Na4S2O3中S元素的平均化合价为+1价,应为Na2SO3和Na2S的混盐,混盐CaOCl2中相当于含有CaCl2和Ca(ClO)2两种盐。
A.由分析可知Na4S2O3为Na2SO3和Na2S的混盐,Na2SO3和Na2S都是强碱弱酸盐,溶液呈碱性,A正确;
B.由分析可知Na4S2O3为Na2SO3和Na2S的混盐,所以1molNa4S2O3中共含离子数为2+1+2+1=6NA,B错误;
C.由![]() 可知,生成单质硫的S元素化合价由+1变为0,则每产生3molS,转移电子的物质的量为3mol,C错误;
可知,生成单质硫的S元素化合价由+1变为0,则每产生3molS,转移电子的物质的量为3mol,C错误;
D.在酸性条件下,发生反应:Cl-+ClO-+2H+=Cl2↑+H2O,即向CaOCl2中加入足量稀硫酸会有Cl2产生,D正确;
答案选AD。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).下列分析正确的是
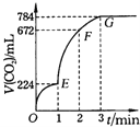
A.OE、EF、FG三段中,该反应用CO2表示的平均反应速率之比为2:6:7
B.EF段,用盐酸表示该反应的平均反应速率为2.4mol/(Lh)
C.G点表示收集的CO2的量最多
D.OE段表示的平均速率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题。
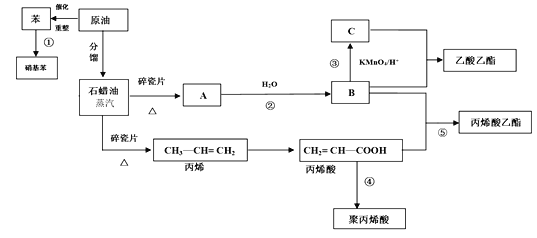
(1)丙烯酸中的官能团的名称为_______。
(2)反应①的化学方程式_______;反应⑤的化学方程式_______。
(3)丙烯酸(CH2 = CH—COOH)可能发生的反应有_______(填序号)
A.加成反应 B.取代反应 C.加聚反应 D.中和反应 E.氧化反应
(4)聚丙烯酸的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法错误的是( )
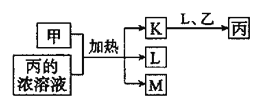
A.X、Y、Z三种元素的第一电离能:![]()
B.X分别与Y、Z、W形成的分子中均可能含有非极性共价键
C.Z元素的最高价含氧酸的酸性在同周期和同主族元素中均最强
D.若固体![]() 是由直线形的
是由直线形的![]() 和平面三角形的
和平面三角形的![]() 组成,则
组成,则![]() 与丙溶液中的溶质阴离子相同
与丙溶液中的溶质阴离子相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组同学猜想自来水中可能含有大量Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1) 通过实验可初步确定自来水中________(填“含有”或“不含有”)大量Ca2+、Mg2+。
(2) 自来水中所含阴离子可以确定有___________,该离子遇AgNO3溶液发生反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Pd-Mg/SiO2催化剂上CO2甲烷化反应机理如图所示。下列说法错误的是( )
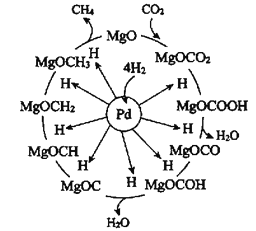
A.上述甲烷化过程总反应可表示为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
B.整个甲烷化过程真正起催化作用的物质为MgO
C.Pd-Mg/SiO2催化剂加快了甲烷化速率,提高了H2的平衡转化率
D.经过一个加氢循环后的MgO再次与CO2结合形成碳酸盐,继续一个新的加氢循环过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g) ![]() 2C(g),达到平衡的标志是
2C(g),达到平衡的标志是
A.C生成的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间内生成n molA,同时消耗2nmol C
D.单位时间内生成n molA,同时消耗3nmol B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com