
| ①H2SO4溶液: HSO4- H++SO42- | ②NaHSO4溶液: HSO4- H++SO42- | ③盐酸 HCl=H++Cl |
| 10% | 29% | 100% |
| 消耗量 |
| 起始量 |
| 0.6×0.6 |
| 0.4×1.8 |
| 消耗量 |
| 起始量 |
| 0.6mol/L |
| 2.4mol/L |
| 22 |
| 2×(a-2) |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
| A、0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| B、常温常压下,1mol的氦气和氢气混合气,含有的核外电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2 NA |
| D、标准状况下,2.24L CCl4和CH2O的混合物中含有NA个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
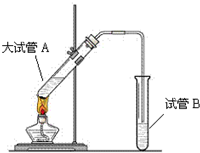 “酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.
“酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.查看答案和解析>>
科目:高中化学 来源: 题型:
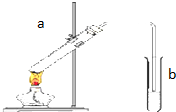 用如图所示的装置制取乙酸乙酯.回答下列问题:
用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol?L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较H2SiO3和H2CO3的酸性强弱 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
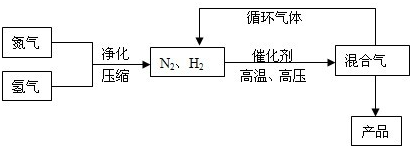
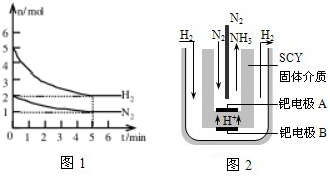
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com