
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
分析 (1)①已知:Ⅰ.Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
Ⅱ.C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
根据盖斯定律,①-②×3可得:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);
②PdCl2被还原成单质,CO被氧化为CO2,由元素守恒可知还生成HCl;
(2)①负极发生氧化反应,丙烷在负极失去分子,碱性条件下生成碳酸根离子与水;
②通电后,溶液中产生大量的白色沉淀,且较长时间不变色,生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子;
(3)①实验2中起始物质的量为实验1中的一半,若温度相等,为等效平衡,反应气体气体体积不变,平衡时同种组分的转化率相等,故二氧化碳为0.8mol,由于升高温度,实验2中二氧化碳为0.4mol<0.8mol,故升高温度平衡逆向移动;
②计算平衡时各组分物质的量,由于反应气体气体物质的量不变,用物质的量代替浓度代入K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算平衡常数;
③实验3跟实验2相比,起始温度、浓度均相同,且平衡浓度相同,但实验3的反应速率大,反应前后气体体积不变,则可能使用了催化剂或增大了压强等.
解答 解:(1)①已知:Ⅰ.Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
Ⅱ.C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
根据盖斯定律,①-②×3可得:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②PdCl2被还原成单质,CO被氧化为CO2,由元素守恒可知还生成HCl,反应方程式为:PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)①负极发生氧化反应,丙烷在负极失去分子,碱性条件下生成碳酸根离子与水,负极电极反应式为:C3H8+26OH--20e-=3CO32-+17H2O,
故答案为:C3H8+26OH--20e-=3CO32-+17H2O;
②通通电后,溶液中产生大量的白色沉淀,且较长时间不变色,生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子.
A.电源中的a与A相连,则a为正极,b与B相连,则b为负极,故A正确;
B.可以用NaCl溶液作为电解液,阴极氢离子放电生成碱,故B正确;
C.B的电极材料任选,而A电极一定为Fe,故C错误;
D.阴极氢离子放电,其电极反应为2H++2e-=H2↑,故D正确;
故答案为:ABD;
(3)①实验2中起始物质的量为实验1中的一半,若温度相等,为等效平衡,反应气体气体体积不变,平衡时同种组分的转化率相等,故二氧化碳为0.8mol,由于升高温度,实验2中二氧化碳为0.4mol<0.8mol,故升高温度平衡逆向移动,故正反应为放热反应,
故答案为:放热;
②CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):1 2 0 0
变化量(mol):0.4 0.4 0.4 0.4
平衡量(mol):0.6 1.6 0.4 0.4
由于反应气体气体物质的量不变,用物质的量代替浓度计算平衡常数,故K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.4×0.4}{0.6×1.6}$=$\frac{1}{6}$,
故答案为:$\frac{1}{6}$;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动,应是使用了催化剂,又由于反应前后气体体积不变,则增大了压强,平衡也不移动,也可能为压强的增大,
故答案为:使用了催化剂或增大了压强.
点评 本题考查化学平衡计算与影响因素、盖斯定律应用、电化学等,题目综合性较强,对基础知识掌握、分析解决问题能力要求较高,题目难度中等.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 14C原子的结构示意图: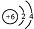 | |
| B. | H2O2的电子式: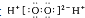 | |
| C. | NH4C的电子式: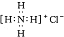 | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:ClO-、Cl-、K+、HSO3- | |
| B. | 无色强酸性溶液中:Na+、Cl-、SO42-、[Cu(NH3)4]2+ | |
| C. | 水电离产生的c(H+)=10-13 mol•L-1的溶液中:Na+、Cl-、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 33.3% | C. | 50% | D. | 66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
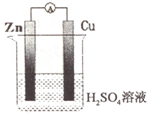
| A. | .锌作负极 | B. | 铜电极上发生氧化反应 | ||
| C. | .铜作负极 | D. | 锌电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com