
| A. | 瓶中气体的黄绿色逐渐变浅 | |
| B. | 瓶内壁有油状液滴形成 | |
| C. | 此反应的生成物只有一氯甲烷 | |
| D. | 此反应的液态生成物为二氯甲烷、三氯甲烷及四氯化碳的混合物 |
分析 甲烷和氯气发生取代反应,生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,一氯甲烷是气体,生成的氯化氢极易溶于水,其中的有机产物均难溶于水,生成的产物均无色,试管中气体颜色会变浅,据此判断.
解答 解:A.甲烷和氯气发生取代反应,生成的产物均无色,试管中气体颜色会变浅,故A正确;
B.甲烷和氯气发生取代反应,生成的二氯甲烷、三氯甲烷、四氯化碳,三种物质都是油状,故B正确;
C.甲烷和氯气发生取代反应,生成的是CH3Cl、CH2Cl2、CHCl3、CCl4和HCl的混合物,故C错误;
D.甲烷和氯气发生取代反应,生成的二氯甲烷、三氯甲烷、四氯化碳为液态物质,故D正确;
故选:C.
点评 本题考查了有机物结构与性质,明确甲烷结构特点及发生取代反应及产物性质是解题关键,题目难度不大.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化硫中含有的氧原子数为0.3NA | |
| C. | 常温下,2.7 g Al与足量的盐酸反应,生成H2的分子数为0.15NA | |
| D. | 常温下,0.1 mol•L-1MgCl2溶液中含Cl-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}$U可用于制造原子弹,也可用作核电站发电的原料 | |
| B. | 利用${\;}_{6}^{14}$C可判断某些文物的生产年代 | |
| C. | 等质量的${\;}_{1}^{2}$H2O、${\;}_{1}^{1}$H2O所含的分子数前者多 | |
| D. | 通过化学反应无法将${\;}_{1}^{2}$H转化为${\;}_{1}^{1}$H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

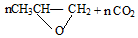 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,将x mol•L-1NaOH溶液滴10mL 0.1mol•L-1的醋酸溶液中,溶液的温度和pH变化如图所示.下列说法正确的是( )
室温下,将x mol•L-1NaOH溶液滴10mL 0.1mol•L-1的醋酸溶液中,溶液的温度和pH变化如图所示.下列说法正确的是( )| A. | x=0.1 | |
| B. | 滴定过程中应该选择甲基橙作为指示剂 | |
| C. | c点对应的溶液中水的电离程度最大 | |
| D. | b点对应的溶液中c(H+)=(OH-)=C(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,向一定体积0.1mol•L-1一元弱酸HA溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-1gc(OH-)]的变化关系如图所示. 下列说法错误的是( )
某温度下,向一定体积0.1mol•L-1一元弱酸HA溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-1gc(OH-)]的变化关系如图所示. 下列说法错误的是( )| A. | 此温度下,水的离子积常数为1.0×10-2a | |
| B. | M、N两点所示的溶液中,水的电离程度相同 | |
| C. | Q点消耗的NaOH溶液的体积等于HA溶液的体积 | |
| D. | N点溶液加水稀释,$\frac{c({A}^{-})}{c(HA)}$减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com