
| A. | 滴加前:c(NH4+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 滴加前:c(NH4+)+c(NH3•H2O)=c(SO42-) | |
| C. | 滴加至完全沉淀:c(OH-)>c(NH4+)>c(H+) | |
| D. | 滴加至中性:c(SO42-)=2c(NH4+)>c(H+)=c(OH-) |
分析 A.根据硫酸铵溶液中的电荷守恒判断;
B.根据硫酸铵溶液中的物料守恒分析;
C.完全沉淀时硫酸铵和氢氧化钡的物质的量相等,反应后溶质为一水合氨,结合电荷守恒判断;
D.溶液为中性时,2c(SO42-)=c(NH4+).
解答 解:A.滴加前为硫酸铵溶液,根据电荷守恒可知:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),故A错误;
B.滴加前为(NH4)2SO4溶液,根据物料守恒的:c(NH4+)+c(NH3•H2O)=2c(SO42-),故B错误;
C.滴加至完全沉淀,二者恰好反应生成硫酸钡沉淀和一水合氨,根据电荷守恒可知:c(OH-)=c(H+)+c(NH4+),则溶液中离子浓度大小为:c(OH-)>c(NH4+)>c(H+),故C正确;
D.滴加至中性时:c(H+)=c(OH-),根据电荷守恒可知:2c(SO42-)=c(NH4+),正确的离子浓度大小为:2c(SO42-)=c(NH4+)>c(H+)=c(OH-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确溶液中溶质组成为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Ag+、Cl- | B. | Ba2+、H+、CO32- | C. | K+、Al3+、OH- | D. | Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
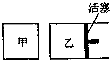 在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g)并达到平衡.在反应过程中,
在容积相同的甲、乙两个容器中(如图所示),分别充入2molSO2和2molO2,使它们在相同温度下发生反应2SO2(g)+O2(g)?2SO3(g)并达到平衡.在反应过程中,| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
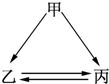 下列各组物质不能一步实现如图转化关系的是( )
下列各组物质不能一步实现如图转化关系的是( )| 物质 组别 | 甲 | 乙 | 丙 |
| A | Na | NaOH | NaCl |
| B | AlO3 | Na AlO2 | Al(OH)3 |
| C | CuO | Cu(OH)2 | CuSO4 |
| D | Fe | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 结论 |
| A | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 溶液中含有NH4+ |
| B | 将浓硝酸滴入碳酸钠溶液中,然后将生成的气体直接通入硅酸钠溶液中,溶液变浑浊. | 酸性:硝酸>碳酸>硅酸 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,溶液变成蓝色 | 氧化性:I2>Cl2 |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分子代号 | 甲 | 乙 | 丙 | 丁 |
| 电子数 | 10 | 16 | 18 | 26 |
| A. | 四种气体中至少有两种气体分子互为同分异构体 | |
| B. | 四种气体通入溴的四氯化碳溶液中,都能使其褪色 | |
| C. | 气体乙的分子内所有的原子在同一平面上 | |
| D. | 鉴别丙和丁两种气体,可以用高锰酸钾酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的两种氧化物中阴阳个数比均为1:2 | |
| B. | Y的氧化物熔点高,常用作耐高温材料 | |
| C. | Z的氧化物属于酸性氧化物,不能与任何酸反应 | |
| D. | R的同主族氢化物稳定性从上往下依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
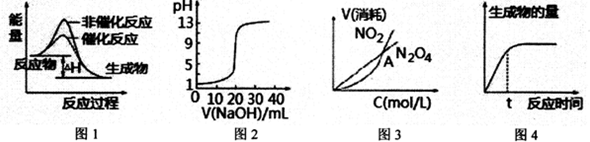
| A. | 图l表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1 000mol•L-1 CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
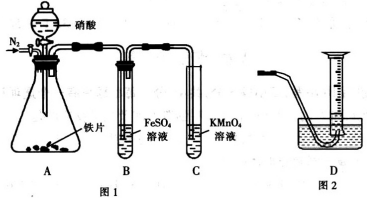 为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.
为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.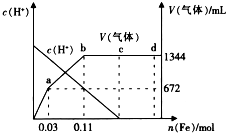
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com