
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.04mg/L的废水,理论需用4.010-5molCl2处理 |
分析 反应2CN-+8OH-+5Cl2=2CO2↑+N2↑+10Cl-+4H2O中,Cl元素的化合价由0降低为-1价,N元素的化合价由-3价升高为0,C元素的化合价由+2价升高为+4价,该反应中转移10e-,以此解答.
解答 解:A.C、N元素化合价都升高,则氧化产物有N2、CO2,故A错误;
B.NaCN的水溶液呈碱性,说明CN-水解促进水的电离,为强碱若酸盐,故B正确;
C.由反应可知,生成2molCO2的同时,生成10molCl-,反应前后阴离子数目不变,则当有0.2mol CO2生成时,溶液中阴离子的物质的量不变,故C错误;
D.n(CN-)=$\frac{1.04×1{0}^{-3}g}{26g/mol}$=4.0×10-5mol,由方程式可知需要1×10-4mol 氯气,故D错误.
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及氧化还原反应中规律性知识为解答的关键,选项D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
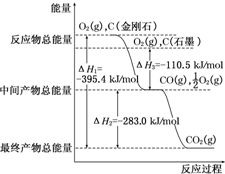 (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:解答题
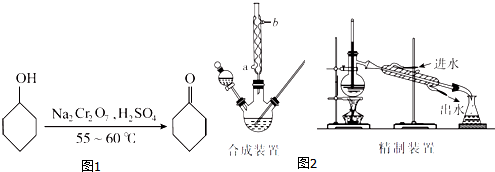
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.25 mol | C. | 0.35 mol | D. | 0.45 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②③ | C. | ①③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
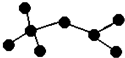 如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
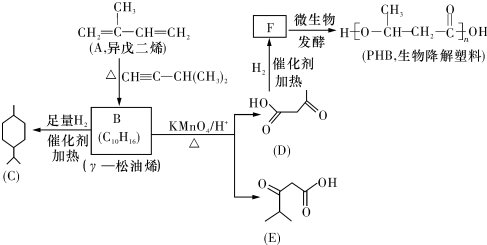
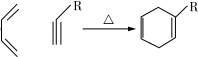
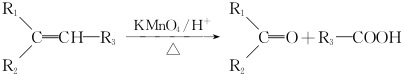
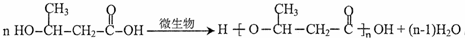 .
.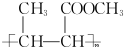 (一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是
(一种类似有机玻璃的塑料).在催化剂作用下,第三步反应的化学方程式是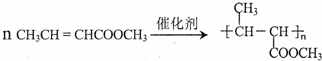 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
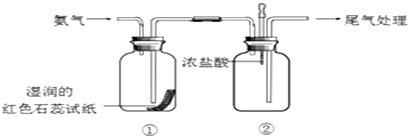
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com