
分析 ①根据N原子守恒可求得参加反应的氨的物质的量,根据氧化还原反应中得失电子守恒可求得NO与NO2的物质的量;
②根据质量守恒可求得反应后溶液质量,进而求得溶液的体积和溶液的浓度.
解答 解:①根据N原子守恒可求得参加反应的氨的物质的量.
n(NH3)+180mol=156mol×2,n(NH3)=132mol.
根据氧化还原反应中得失电子守恒可求得NO与NO2的物质的量.
设为NO的物质的量X,NO2的物质的量为(180mol-X),
132mol×3=Xmol×2+(180-X)mol×4,X=162mol,(180mol-X)=18mol,
NO与NO2体积比为162:18=9:1.
故答案为:9:1;
②根据质量守恒可求得反应后溶液质量.
8.90×103g+162mol×30g•mol-1+18mol×46gmol-1-156mol×28g•mol-1=10220g,
其溶液体积为10220g÷0.980g•cm-3=10428cm3=10428mL=10.428L,
反应后溶液中剩余溶质氨的物质的量是8.90×103g×0.300÷17g•mol-1-132mol=25.058mol,
吸收后氨水的物质的量浓度为25.058mol÷10.428L=2.4 mol•L-1.
故答案为:2.4mol/L.
点评 本题考查较为综合,涉及混合物的计算、分子式的确定以及化学方程式的有关计算,题目难度较大,注意从质量守恒的角度分析.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1mol CuS04 还原了$\frac{1}{4}$mol S | |
| D. | 被还原的S和被氧化的S的质量比为7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
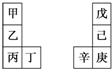 甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 丙与庚的原子序数相差3 | |
| B. | 气态氢化物的热稳定性:戊>己>庚 | |
| C. | 乙所在周期元素中,其简单离子的半径最大 | |
| D. | 乙的单质在空气中燃烧生成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
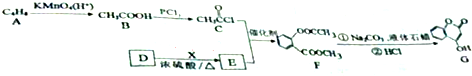
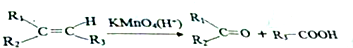
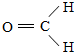 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
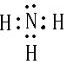 ,该氢化物中含有的化学键是极性共价键.
,该氢化物中含有的化学键是极性共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=2△H1+△H2+△H3 | B. | △H=△H1+△H2+△H3 | ||
| C. | △H=△H1+2△H2+2△H3 | D. | △H=2△H1+△H2-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Fe3+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | C6H5OH、Fe3+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中一定有K+、Br-、CO32-、AlO2- | |
| B. | 溶液中一定没有Mg2+、Cu2+、Cl-、NH4+ | |
| C. | 不能确定溶液中是否有K+、SO42-、Cl- | |
| D. | 往第3份溶液中滴加BaCl2可确认是否有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯碱溶液能清洗油污:CO32-+H2O?HCO3-+OH- | |
| B. | 配制FeSO4溶液时加入适量的铁粉:Fe3++Fe→2Fe2+ | |
| C. | 含1molNaOH和1molNa2CO3的混合溶液中滴入含1.5molHCl的稀盐酸:2OH-+CO32-+3H+→HCO3-+2H2O | |
| D. | NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com