
【题目】铁及其化合物在日常生活中有广泛应用。
(1)写出铁元索在周期表中的位置__________。
(2)写出在空气中Fe(OH)2转化为Fe(OH)3的化学方程式____________。
(3)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。
①由FeSO4溶液制得FeSO4·7H2O过程中的操作有______、过滤、洗涤、干燥。
②检验绿矾是否变质的试剂是________。
(4)利用绿矾制备还原铁粉的工业流程如下:
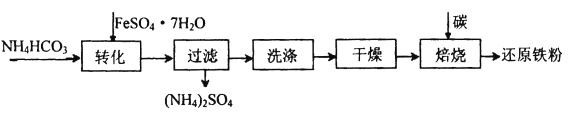
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为_______________。
②取干燥后的FeCO3样品12.49g,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量___________。
(5)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
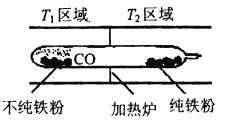
Fe(s)+5CO(g)![]() Fe(CO)5(g) △H<0,T1___T2(填“>”、“<”或“=”)。
Fe(CO)5(g) △H<0,T1___T2(填“>”、“<”或“=”)。
【答案】 第四周期第Ⅷ族 4Fe(OH)2+O2+2H2O==4Fe(OH)3 蒸发浓缩、冷却结晶 KSCN溶液 4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O 0.89g <
【解析】(1)铁的核电荷数为26,核外电子排布为1s22s22p63s23p63d64s2,位于周期表中第四周期第Ⅷ族;正确答案:第四周期第Ⅷ族。
(2)Fe(OH)2与空气中的氧气、水共同反应生成Fe(OH)3,化学方程式为:4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;正确答案:4Fe(OH)2+O2+2H2O==4Fe(OH)3 。
(3)①由FeSO4溶液先进行加热浓缩,变为浓溶液,然后冷却结晶、过滤、洗涤、干燥等操作,制得FeSO4·7H2O;正确答案:蒸发浓缩、冷却结晶。
②亚铁离子还原性较强,易被氧化为铁离子;因此检验绿矾是否变质,就是要检验铁离子的存在,可以用硫氰化钾溶液,若出现红色溶液,则有铁离子存在,绿矾(FeSO4·7H2O)已变质;正确答案:KSCN溶液。
(4)①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,根据氧化还原反应的电子守恒和原子守恒规律,化学方程式为: 4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O ;正确答案:4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O 。
②设样品中FeCO3的物质的量为xmol, FeOOH的物质的量为ymol,则根据质量守恒和铁原子的量守恒列方程如下:116x+89y=12.49,x+y=6.16/56=0.11,解之得y=0.01mol,样品中杂质FeOOH的质量为0.01×89=0.89g,正确答案:0.89g。
(5)反应Fe(s)+5CO(g)![]() Fe(CO)5,△H<0,铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到较高温度区域T2时,羰基合铁分解,纯铁粉残留在右端,一氧化碳循环利用,所以T1<T2;正确答案:<。
Fe(CO)5,△H<0,铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到较高温度区域T2时,羰基合铁分解,纯铁粉残留在右端,一氧化碳循环利用,所以T1<T2;正确答案:<。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.SO2能使FeCl3、酸性KMnO4溶液变色或褪色B.可以用澄清石灰水来鉴别SO2与CO2
C.可将SO2通过很高的烟囱排放到大气中D.少量SO2通入浓的CaCl2溶液中可以生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氨和肼(N2H4)是两种最常见的氮氢化物。
己知:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为_________,该反应的化学平衡常数K=____(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为_________,该反应的化学平衡常数K=____(用K1、K2表示)。
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是____(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆 D.容器中混合气体的平均摩尔质量不变
②图1为容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)= ____,平衡时NO的转化率为____。

(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式_________。用离子方程式表示吸收池中除去NO的原理__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 3.01×1023个OH的物质的量为________mol,含有质子的物质的量为_____mol,含有电子的物质的量为________mol,这些OH和________g Na+含有的电子数相同。
(2)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为______;
(3)等质量的SO2和SO3的物质的量之比_______;氧原子个数比为_________;
(4)11.1gCaCl2固体溶于水配成500mL溶液,其浓度为_____ mol·L-1,从中取出100 mL溶液,其中Cl-的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物有着十分重要的用途:如氨基乙酸铜[结构简式为(H2NCH2COO)2Cu]常用作食品补铜剂及矿物元素饲料添加剂,硒化铜纳米晶在光电转化中有着广泛地应用;硫酸铜可用作配制农药等。
(1)基态硒原子的电子排布式为____,基态氮原子电子的空间运动状态有__种,与硒同周期相邻的三种元素第一电离能由大到小的顺序为______
(2)(H2NCH2COO)2Cu氨基乙酸铜中,碳原子的杂化轨道类型是______;与氮原子成键的原子(含氮原子本身)形成的空间构型是__________。
(3)硫酸铜晶体的组成可表示为[Cu(H2O)4]SO4·H2O,实验测得该物质中存在氢键且水分子成“键”情况与冰中类似,则1mol[Cu(H2O)4]SO4·H2O中氢键数目为__NA。
(4)硫酸铜在高温下分解有可能得到CuO、Cu2O、SO2、SO3等物质,其中CuO的熔点为1026℃。
①CuO的晶体类型是_____,熔点Cu2O>Cu2S的原因是______
②SO2与SO3中,属于非极性分子的是__,SO2在溶剂水与溶剂CCl4中,相同温度能溶解更多SO2的溶剂是___________
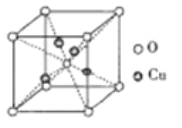
③铜的某种氧化物的晶胞如下图所示,则该氧化物的化学式为_______,若组成粒子氧、铜的半径分别为rOpm、rCupm,密度ρg/cm3,阿伏加德罗常数值为NA,则该晶胞的空间利用率为______(用含π的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com