
| A. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 | |
| B. | 浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸 | |
| C. | K2FeO4具有还原性,可用于自来水的杀菌消毒 | |
| D. | SO2具有漂白性,能使紫色KMnO4溶液褪色 |
分析 A.双氧水的分解反应中二氧化锰作催化剂;
B.常温下,铝和浓硝酸发生钝化现象而阻止进一步反应;
C.高铁酸钾具有强氧化性,能杀菌消毒;
D.二氧化硫能被强氧化剂氧化而体现还原性.
解答 解:A.双氧水的分解反应中二氧化锰作催化剂,加快双氧水分解速率,故A错误;
B.常温下,铝和浓硝酸发生氧化还原反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象是钝化现象,所以可以用铝槽车运输浓硝酸,故B正确;
C.高铁酸钾具有强氧化性,能使蛋白质变性而能杀菌消毒,高铁酸钾杀菌消毒体现高铁酸钾的氧化性,故C错误;
D.高锰酸钾具有强氧化性,能被二氧化硫还原而褪色,该反应中二氧化硫体现还原性而不是漂白性,故D错误;
故选B.
点评 本题考查元素化合物性质,为高频考点,涉及二氧化硫还原性、高铁酸钾氧化性、钝化现象等知识点,注意区分二氧化硫还原性和漂白性区别.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
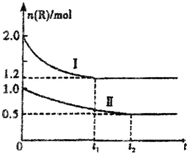 向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )
向甲、乙两个体积相同的恒容容器中,分别充入2mol气体R和1mol气体R,相同温度下,发生下列反应:xR?M+N(正反应为吸热反应).两容器中R的物质的量随时间的变化如图所示.下列说法正确的是( )| A. | 将甲升温,可使甲和乙中各物质的体积分数达到相同 | |
| B. | x=2,且M、N中仅有一种为气态 | |
| C. | 曲线II为甲中R的物质的量一时间图象 | |
| D. | 其他条件不变时,向乙中再加入1mol M、1molN,达到新平衡时,则有1.0mol<n(R)<1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾是常用的净水剂、具有杀菌、消毒的作用 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 考古时,利用14C测定一些文物的年代 | |
| D. | 煤的干馏和石油的分馏都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溴乙烷滴入AgNO3溶液中,立即有淡黄色沉淀生成 | |
| B. | 溴乙烷与NaOH的水溶液共热可制取乙烯 | |
| C. | 溴乙烷难溶于水,能溶于多种有机溶剂 | |
| D. | 实验室通常用乙烯与溴水反应来制取溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中HSO3-的水解离子方程式:HSO3-+H2O?SO32-+H3O+ | |
| B. | Fe(OH)3的溶解平衡方程式:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq) | |
| C. | 溶液中SO32-的水解离子方程式:SO32-+2H2O?H2SO3+2OH- | |
| D. | CaCO3在水中的电离方程式:CaCO3?Ca2++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com