
 能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式
能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、铁溶于稀硝酸,溶液变为浅绿色:Fe+4H++NO3-═Fe3++NO↑十2H2O |
| B、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
C、向水杨酸(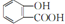 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
| D、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铵固体与消石灰反应制备氨气:NH4++OH-=NH3↑+H2O | ||||
B、用石墨棒作电极电解饱和食盐水:Cl-+Na+
| ||||
| C、硫酸铝溶液与过量氨水反应的离子方程式:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ | ||||
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 模拟海水中的离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
| A、沉淀物X为CaCO3 |
| B、滤液M中存在Mg2+和Ca2+ |
| C、滤液N中存在Mg2+、Ca2+ |
| D、步骤②中若改为加入4.2g NaOH固体,沉淀物Y只有Mg(OH)2 |
查看答案和解析>>
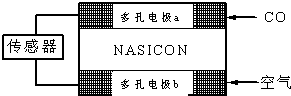
科目:高中化学 来源: 题型:
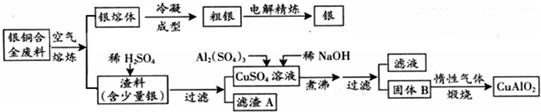
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
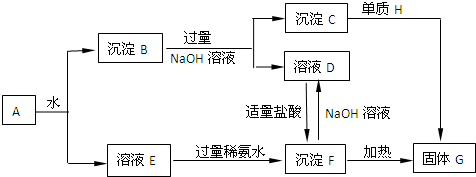
查看答案和解析>>
科目:高中化学 来源: 题型:
 某混合溶液中可能大量含有的离子如下表所示:
某混合溶液中可能大量含有的离子如下表所示:| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,该电池利用质子交换膜传导H+,电池总反应为:2CH3OH+3O2=2CO2(g)+4H2O某化学兴趣小组同学研究甲醇-空气燃料电池原理,并进一步进行电化学实验,其实验装置示意图如图.
甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,该电池利用质子交换膜传导H+,电池总反应为:2CH3OH+3O2=2CO2(g)+4H2O某化学兴趣小组同学研究甲醇-空气燃料电池原理,并进一步进行电化学实验,其实验装置示意图如图.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-770 kJ/mol |
| B、-l220 kJ/mol |
| C、-1500kJ/mol |
| D、-2740kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com