
分析 (1)反应热=反应物总键能-生成物总键能,据此计算;
(2)令氢气和甲烷的物质的量分别为xmol、ymol,根据二者体积与燃烧放出的热量列方程计算x、y的值,再根据m=nM计算氢气的质量;
根据盖斯定律构造目标热化学方程式,据此计算解答.
解答 解:(1)断裂1mol H-H键吸收的能量为436kJ,断裂1mol Cl-Cl键吸收的能量为247kJ,由反应化学方程式H2(g)+Cl2(g)═2HCl(g)△H=-185kJ/mol,可知436kJ/mol+247kJ/mol-2E(H-Cl)=-185kJ/mol,解得E(H-Cl)=434KJ/mol,
故答案为:434KJ/mol;
(2)令氢气和甲烷的物质的量分别为xmol、ymol,根据二者体积与燃烧放出的热量,则:
$\left\{\begin{array}{l}{x+y=\frac{22.4}{22.4}}\\{\frac{571.6}{2}x+890.3y=588.05}\end{array}\right.$,解得x=0.5mol,y=0.5mol,
故氢气的质量为0.5mol×2g/mol=1g,
已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 KJ•mol-1
②C(石墨)+O2(g)═CO2(g)△H=-393.5KJ•mol-1
③2H2(g)+O2(g)═2H2O(l)△H=-571.6 KJ•mol-1
根据盖斯定律,②+③-①得C(石墨)+2H2(g)=CH4(g),故△H=(-393.5KJ/mol)+(-571.6KJ/mol)-(-890.3KJ/mol)=-74.8KJ/mol,
故答案为:1g;-74.8KJ/mol.
点评 本题考查反应热的有关计算,难度中等,注意掌握根据盖斯定律、热化学方程式、燃烧热等进行的计算.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:推断题
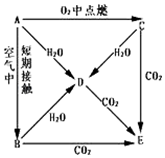 A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.
A、B、C、D、E五种物质焰色反应均为黄色,它们按图所示关系相互转化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | NaOH | NOAlO2 | Al(OH)3 | AlCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| C. | 10 L pH=1的硫酸溶液中含有的H+为2NA | |
| D. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸应保存在塑料盖的玻璃瓶中 | |
| B. | 浓盐酸一定要存放在棕色瓶中,可防止挥发 | |
| C. | 液溴应盛放在橡胶塞的棕色瓶中 | |
| D. | 固态碘应放在广口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 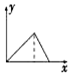 | B. | 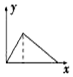 | C. | 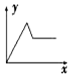 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 电离常数K |
| HX | 9×10-7 |
| HY | 9×10-6 |
| HZ | 1×10-2 |
| A. | 三种酸的强弱关系:HX>HY>HZ | |
| B. | 反应HZ+Y -=HY+Z -能够发生 | |
| C. | 相同温度下,0.1mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大 | |
| D. | 相同温度下,1mol/L HX溶液的电离常数大于0.1mol/L HX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com