
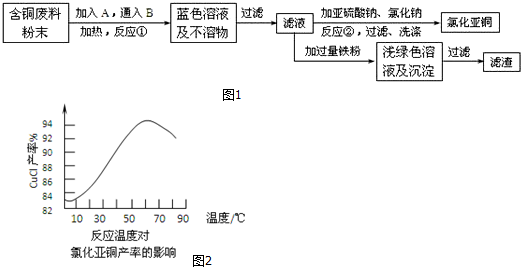
分析 含铜废料加入硫酸,在加热条件下通入氧气可发生反应生成硫酸铜,经过滤后,在滤液中加入亚硫酸钠,发生氧化还原反应生成CuCl,在滤液中加入铁粉,发生置换反应生成硫酸亚铁和铜,以此解答该题.
解答 解:(1)金属铜和稀硫酸不反应,但是在鼓入空气的条件下会发生反应生成硫酸铜,所以A是稀硫酸,B是空气,
故答案为:稀硫酸;空气;
(2)由图示可知,反应物有:Cu2+、SO32-、Cl-,生成物有Cu2Cl2、SO42-,由于是氧化还原反应,化合价发生了变化,根据电子得失和质量守恒进行配平:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+,在反应②的溶液中加适量稀碱溶液,OH-中和了反应中的H+,有利于平衡向右进行,提高CuCl的产率,但当OH-浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降减了CuCl的产率,
故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;OH-中和了反应生成的H+,有利于反应向右进行,提高Cu2Cl2的产率;Cu2+能与OH结合,生成沉淀,反而降低了Cu2Cl2的产率造成产物不纯;
(3)因在53℃~55℃时CuCl产率最大,根据信息可知,随温度升高,促进了CuCl的水解,CuCl被氧化的速度加快.
故答案为:53℃~55℃;温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气发生反应;
(4)因温度升高,促进了CuCl与空气中氧气发生反应,所以反应①在隔绝空气条件下(还原气氛)进行可以提高CuCl的产率.故答案为:隔绝空气密封保存.
点评 本题主要考查了CuCl的制备,为高频考点,对制备过程中的有关知识进行了考查,氧化还原反应实质和规律的应用,培养了学生分析问题的能力和运用知识的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ac.(填序号).
ac.(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键能:H-F>H-Cl>H-Br>H-I | |
| B. | 还原性:Cl-<Br-<Fe2+<I- | |
| C. | 反应热:C(s)+O2(g)=CO2(g)△H1CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2△H1>△H2 | |
| D. | 酸性:向次氯酸钠溶液中通入少量的二氧化碳,发生ClO-+CO2+H2O=HCO${\;}_{3}^{-}$+HClO则说明酸性:H2CO3>HClO>HCO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
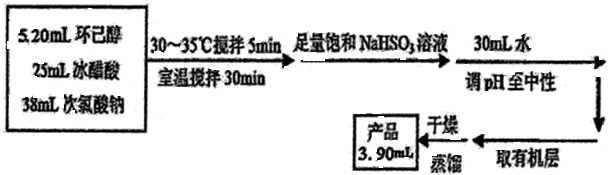
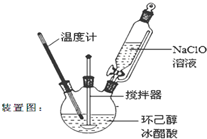 环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为:
环己酮是重要化工原料,是制造尼龙、己内酰胺和己二酸的主要中间体.某化学兴趣小组尝试用次氯酸钠制备环己酮.方程式为: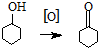
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外,还需要的其它玻璃仪器 |
| 12.5g | 250mL | 烧杯、玻璃棒、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘化钾 | B. | 淀粉碘化钾溶液 | C. | 碘酒 | D. | 溴水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com