
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、NO2 的混合气体,这些气体与1.68升O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则和铜反应的硝酸的物质的量可能是( )
A.0.4mol B.0.55mol C.0.6mol D.0.65mol
科目:高中化学 来源: 题型:
由于工业发 展,燃烧设备不断增多,设备规模不断增大。这些工厂排放的烟气中都会有大量的
展,燃烧设备不断增多,设备规模不断增大。这些工厂排放的烟气中都会有大量的 SO2废气。据统计,我国1995年工业SO2的排放量为1 396万吨,2006年工业SO2的排放量达到了3 800万吨,由于SO2的污染,我国每年损失高达1 100亿元。
SO2废气。据统计,我国1995年工业SO2的排放量为1 396万吨,2006年工业SO2的排放量达到了3 800万吨,由于SO2的污染,我国每年损失高达1 100亿元。
(1)写出两个工业生产过程中产生SO2的实例:
①________________________________________________________________________、
②________________________________________________________________________。
(2)防治SO2污染可采用的措施有(写出三种):
①________________________________________________________________________、
②________________________________________________________________________、
③___________________ _____________________________________________________。
_____________________________________________________。
(3)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气 液接触,通入空气后生成石膏(CaSO4·2H2O),经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
液接触,通入空气后生成石膏(CaSO4·2H2O),经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:
________________________________________________________________________
________________________________________________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:________________________________________________________________________
_____________ ___________________________________________________________。
___________________________________________________________。
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是__________________。
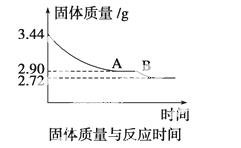
(4)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如下图所示。数据表明当固体的质量为2.72 g后不再改变。求:
①石膏的化学式。②图像中AB段对应化合物的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态Ni原子的价电子(外围电子)排布式为 ;
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式 、 ;
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应。
如①CH2=CH2、②HC≡CH、③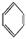 、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
、④HCHO,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形;
(4)Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。该合金的化学式为 ;

查看答案和解析>>
科目:高中化学 来源: 题型:
工业上焙烧明矾[ KAl(SO4)2·12H2O]的化学方程式为:
4 KAl(SO4)2·12H2O+3S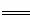 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4
B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-)
C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M= 474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2
NaAlO2+3Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的 pH 在 5.0~6.0 之间,通过电解生成 Fe(OH)3 沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成 浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示: (1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,则无法使悬浮物形成浮渣。
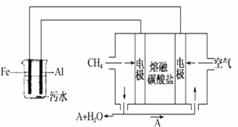
此时,应向污水中加入适量的_________。
a. H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是①______________;
②4OH--4e-=2H2O+O2↑
(3)电极反应①和②的生成物反应得到 Fe(OH)3 沉淀的离子方程式是__________。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以 CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是 CH4+4CO2-8e-===5CO2+2H2O。
①正极的电极反应是______________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。 则 A 物质的化学式是___________。
(5)实验过程中,若在阴极产生了 44.8L(标准状况)气体,则熔融盐燃料电池消耗 CH4_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标况下,11.2L乙烷中含有共价键的数目为3NA
B.标况下,22.4LO2和C O2组成的混合物中含有氧原子数为2NA
O2组成的混合物中含有氧原子数为2NA
C.常温下,22.4L甲烷中含有的电子数为10NA
D.常温下,1 L 0.1mol·L-1的Na2CO3溶液中含OH-离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
500 mL 2 mol/L FeCl3溶液和500 mL 2 mol/L明矾溶液分别滴入沸水中,加热制成甲、乙两种分散系,经测定甲分散系中分散质的粒子大小在1~100 nm之间, 乙分散系中分散质的粒子大小在10-9~10-7 m之间。下列关于甲、乙分散系的判断合理的是( )
乙分散系中分散质的粒子大小在10-9~10-7 m之间。下列关于甲、乙分散系的判断合理的是( )
A.在暗室里用一束明亮的“强光”照射甲、乙两种分散系,发现甲有丁达尔效应,乙没有丁 达尔效应
达尔效应
B.向甲、乙两种分散系中分别滴加过量的氢氧化钠溶液,现象都是“先聚沉,后溶 解”
解”
C.蒸干、灼烧FeCl3和明矾溶液会得到对应的固体盐
D.向甲、乙两种分散系中分别滴加过量氢碘酸溶液,现象分别是深褐色溶液、无色溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com