
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(HC2O4-)>c(C2O42-) |
分析 A.草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+;
B.V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4,若溶液为中性,结合电荷守恒可知c(Na+)=2c(C2O42-)+c(HC2O4-);
C.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,C2O42-部分水解,溶液显示碱性;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,溶液中c(C2O42-)>c(HC2O4-).
解答 解:A.草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+,则c(H+)<1×10-2mol•L-1,故A错误;
B.V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4,当电离等于水解,溶液显示中性,则c(H+)=c(OH-),结合电荷守恒可得:c(Na+)=2c(C2O42-)+c(HC2O4- ),故B正确;
C.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,溶液显碱性,则c(H+)<1×10-7mol•L-1,故C错误;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,C2O42-水解生成HC2O4-,则离子浓度为c(Na+)>c(C2O42-)>c(HC2O4-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,明确溶液中的溶质组成为解答的关键,并注意利用溶液中水解的程度及电离的程度、电荷守恒来分析解答.


科目:高中化学 来源: 题型:选择题
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| C. | 电池充电是将电能转化为化学能 | |
| D. | 燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
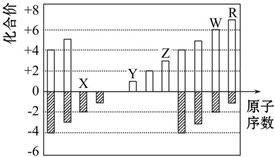
| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一种强酸 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | ${\;}_{12}^{\;}$Mg与水反应缓慢,${\;}_{20}^{\;}$Ca与水反应较快 | ${\;}_{56}^{\;}$Ba(DA族)与水反应会更快 |
| B | 是半导体材料,同族的Ge也是半导体材料 | Ⅳ族的元素都是半导体材料 |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J |
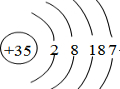 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐 | |
| C. | 某些蔬菜和水果在人体代谢后,生成碱性物质,所以称为碱性食物 | |
| D. | 抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$ | B. | $\frac{{c(N{H_3}•{H_2}O)}}{{c(O{H^-})}}$ | ||
| C. | c(H+)和c(OH--)的乘积 | D. | OH-的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com