
【题目】元素周期表是科学界最重要的成就之一。作为一种独特的工具,它使科学家能够预测地球上和宇宙中物质的外观、性质及结构等。
(1)通常制造的农药含元素F、P、S、Cl。四种元素的电负性从大到小的顺序为_______;第一电离能从大到小的顺序为_________。
(2)科学家曾利用元素周期表寻找F、Cl的含碳化合物作为制冷剂。已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,若要求制冷剂沸点介于两者之间,则含一个碳原子的该制冷剂可以是__________(写出其中一种的化学式)。
(3)1963年以来科学家借助射电望远镜,在星际空间已发现NH3、HC≡C-C≡N等近两百种星际分子。与NH3互为等电子体的阳离子为____;HC≡C-C≡N分子中![]() 键与
键与![]() 键的数目比n(
键的数目比n(![]() )∶n(
)∶n(![]() )=__________。
)=__________。
(4)过渡元素(包括稀土元素)中可寻找各种优良催化剂。Sc的一种氢化物的晶胞结构如图所示,该氢化物的化学式为_________。
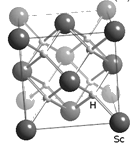
【答案】F>Cl>S>P F>Cl>P>S CFCl3、CF2Cl2、CF3Cl H3O+ 1∶1 ScH2
【解析】
(1)元素的非金属性越强,其电负性越大;一般情况下元素的非金属性越强,其第一电离能越大;同一周期的元素,原子序数越大,元素的第一电离能越大,但第VA元素原子核外电子排布处于半充满的稳定状态,第一电离能大于同一周期相邻元素;
(2)分子中只含有1个C原子,根据C原子价电子为4的原则,F、Cl原子个数和等于4个即可。
(3)等电子体是原子数相等,最外层电子总数也相等的微粒;共价单键是![]() 键,共建双键一个
键,共建双键一个![]() 键一个
键一个![]() 键,共价三键一个
键,共价三键一个![]() 键两个π键;
键两个π键;
(4)用均摊方法计算该物质化学式。
(1)元素的非金属性F>Cl>S>P,所以元素的电负性由大到小的顺序为F>Cl>S>P;
同一主族的元素,原子序数越大,元素的第一电离能越小;同一周期的元素,原子序数越大,元素的第一电离能越大,但第VA元素原子核外电子排布处于半充满的稳定状态,第一电离能大于同一周期相邻元素,所以这四种元素的第一电离能由大到小的顺序为F>Cl>P>S。
(2) CCl4的沸点为76.8℃,CF4的沸点为-128℃,若要求制冷剂沸点介于两者之间,则含一个碳原子的该制冷剂中F、Cl原子数的和等于4个,可以是CFCl3、CF2Cl2、CF3Cl中任何一种。
(3)根据等电子体的概念,NH3的等电子体的阳离子是H3O+;在HC≡C-C≡N分子中含有4个![]() 键、4个π键,二者个数比等于1:1;
键、4个π键,二者个数比等于1:1;
(4)根据Sc、H原子的相对位置可知:在该晶胞中含有8个H原子,含有的Sc原子个数为:8×![]() +6×
+6×![]() =4,Sc:H=4:8=1:2,所以该物质化学式为ScH2。
=4,Sc:H=4:8=1:2,所以该物质化学式为ScH2。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的一组是( )
A. 甘油和乙醇互为同系物
B. CH2=CHCH2CH3 和 CH3CH=CHCH3 互为同分异构体
C.  是同一种物质
是同一种物质
D. O2 和 O3 互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是蜜蜂信息素的成分之一,具有香蕉的香味。实验室中可利用乙酸和异戊醇![]() 制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )

药品 | 密度/( | 沸点/℃ | 水中溶解性 |
异戊醇 | 0.8123 | 131 | 微溶 |
乙酸 | 1.0492 | 118 | 易溶 |
乙酸异戊醇 | 0.8670 | 142 | 难溶 |
A.反应方程式为CH3COOH+![]()
![]()
![]()
B.实验时,冷凝水应从直形冷凝管的b口通入
C.异戊醇的同分异构体中属于醇类的有7种
D.反应后,取Ⅱ中物质经水洗、碱洗和蒸馏可提纯乙酸异戊酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究![]() 溶液和
溶液和![]() 溶液的反应原理。
溶液的反应原理。
(实验一)将含淀粉的![]() 溶液加入
溶液加入![]() 酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
酸性溶液(过量)中,混合后约5秒内无明显变化,随后有少量蓝色出现并迅速变蓝。
(1)溶液变蓝,说明![]() 具有__________性。
具有__________性。
(2)查阅文献:
反应Ⅰ:![]() 慢
慢
反应Ⅱ:![]() _____=_____+_____ 较快
_____=_____+_____ 较快
反应Ⅲ:![]() 快
快
写出酸性条件下,反应Ⅱ的离子方程式__________。
(3)向实验一所得蓝色溶液中加入少量![]() 溶液,蓝色迅速褪去,后又变蓝色。据此得出
溶液,蓝色迅速褪去,后又变蓝色。据此得出![]() 氧化性比
氧化性比![]() 强,该结论______(填“合理”或“不合理”),理由是_________。
强,该结论______(填“合理”或“不合理”),理由是_________。
(4)为了进一步研究![]() 溶液和
溶液和![]() 溶液的反应原理,设计如下实验。
溶液的反应原理,设计如下实验。
(实验二)装置如图所示,![]() 闭合后,电流表的指针偏转情况记录如表:
闭合后,电流表的指针偏转情况记录如表:
表盘 |
|
| ||
时间/min |
|
|
| |
偏转位置 | 右偏至“Y”处 | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针归零 | |
①![]() 闭合后,检验b极附近溶液存在放电产物
闭合后,检验b极附近溶液存在放电产物![]() 的实验操作是__________。
的实验操作是__________。
②![]() 时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断
时,直接向a极区滴加淀粉溶液,溶液未变蓝。取a极附近溶液于试管中,滴加淀粉溶液,溶液变蓝。判断![]() 在a极放电的产物是__________。
在a极放电的产物是__________。
(5)下列关于上述实验解释合理的是__________(填字母序号)。
A.实验一中:5秒内无明显变化,可能是因为反应Ⅰ的活化能太小,反应速率太慢
B.实验二中:指针回到“0”处,可能是因为反应Ⅱ比反应Ⅰ快,导致![]() 难与
难与![]() 发生反应
发生反应
C.实验二中:又返至“X”处,可能是因为发生了反应Ⅲ,重新形成了原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸,25℃时,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是
A. 0.1mol/LNaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
B. 反应HC2O4-+OH-![]() C2O42-+H2O的平衡常数K=5.4×1012
C2O42-+H2O的平衡常数K=5.4×1012
C. 0.1mol/LNa2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
D. pH=7的NaHC2O4与Na2C2O4的混合溶液中:c(Na+)=c(HC2O4-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计实验,探究中和反应的发生。
(实验过程)
编号 | 实验操作 |
实验I | 向滴有酚酞的氢氧化钠溶液中滴加稀盐酸,观察现象
|
实验II | 按如图进行实验,对比①、②中的实验现象
|
(分析与解释)
(1)中和反应的实质是______(用离子方程式表示)。
(2)实验I中,中和反应发生的现象是______。
(3)实验II中,能判断中和反应发生的依据是______。
a.反应结束消耗镁条的量②>①
b.镁条表面产生气泡的速率①>②
(4)实验II中,如果提供温度计、气球(收集气体)等辅助仪器,还能获取证明中和反应发生的实验证据是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. CCl4中C原子sp3杂化,为正四面体形
B. H2S分子中,S为sp2杂化,为直线形
C. CS2中C原子sp杂化,为直线形
D. BF3中B原子sp2杂化,为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6g Na2SO3于100mL烧杯中,加50 mL去离子水搅拌溶解。
②另取4.0 g硫粉于200mL烧杯中,加6 mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2 g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中, ______________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为___________。
(4)滤液中除Na2S2O3和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00 g产品(硫代硫酸钠晶体的摩尔质量为248 g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol/L碘标准溶液滴定至终点,消耗21.00 mL。反应的离子方程式为:2S2O32-+I2=S4O62-+2I-。
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3常用于脱氯剂,在溶液中易被Cl2氧化为SO42-,该反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,可逆反应mA(g) + nB(g)![]() pC(g)的化学平衡常数为K,下列说法正确的是
pC(g)的化学平衡常数为K,下列说法正确的是
A. 其他条件不变,升高温度,K 值一定增大
B. 其他条件不变,增大B(g)的浓度,K值增大
C. 其他条件不变,增大压强,K值不变
D. K值不会随反应条件的改变而改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com