
A.金刚石、C60、一氧化碳 B.石灰石、熟石灰、鸡蛋壳
C.天然气、沼气、瓦斯气 D.冰、干冰、二氧化碳
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 高温 |
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
| ||
| ||
| ||
| 约3000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
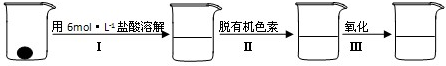
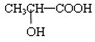 与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:
与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com