
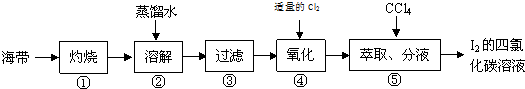
分析 (1)灼烧固体需要使用仪器坩埚;
(2)搅拌,加热,研磨能加快溶解速度;
(3)过滤中用到的玻璃仪器为玻璃杯、烧杯、漏斗;
(4)氯气氧化碘离子为碘单质.
解答 解:(1)灼烧固体需要使用仪器坩埚,故答案为:坩埚;
(2)搅拌,加热,研磨能加快溶解速度,故答案为:充分搅拌;加热煮沸;
(3)过滤中用到的玻璃仪器为玻璃杯、烧杯、漏斗,故答案为:玻璃杯、烧杯、漏斗;
(4)氯气氧化碘离子为碘单质,反应方程式为Cl2+2NaI=2NaCl+I2,故答案为:Cl2+2NaI=2NaCl+I2.
点评 本题考查海带成分中碘的检验,注意掌握萃取和分液的使用条件,掌握分析流程是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 非金属之间形成的化学键不一定是共价键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 在共价化合物中也可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 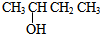 的名称为2-羟基丁烷 的名称为2-羟基丁烷 | |
| B. | 乙酸、乙酸乙酯和淀粉的最简式均为CH2O | |
| C. | (CH3)3CCH2C(CH3)=CH2的名称为 2,2,4-三甲基-1-戊烯 | |
| D. | 按系统命名法CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH${\;}_{4}^{+}$→NH3 | B. | S→S2- | C. | HCl→Cl2 | D. | CO32-→CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 灼烧干海带至完全变成灰烬--坩埚 | |
| C. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2=92.4 | |
| B. | 达平衡时甲、乙中NH3的体积分数乙>甲 | |
| C. | 达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动 | |
| D. | 达平衡时甲中N2的转化率为25% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com