
| X | Y | |
| Z | W |
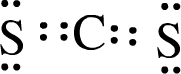 .
.分析 短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,然后依据元素及其单质、化合物的性质来解答.
解答 解:由上述分析可知,X为C,Y为N,Z为P,W为S,
(1)X位于元素周期表中的第二周期IVA族,故答案为:第二周期IVA族;
(2)上述元素的化合物中,硫化氢与浓硫酸可发生氧化还原反应,故答案为:S;
(3)X为C,其最外层4个电子,W为S,其最外层6个电子,XW2的电子式为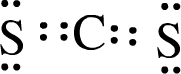 ,故答案为:
,故答案为: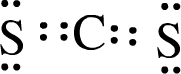 ;
;
(4)P的最高价为+5价,则最高价氧化物对应的水化物的化学式为H3PO4,故答案为:H3PO4;
(5)W 和Y形成的一种二元化合物具有色温效应,N、S的原子个数比为1:1时且W的质量分数约为70%,其相对分子质量在170-190之间,则$\frac{190}{32+14}$≈4,该化合物的化学式为S4N4,故答案为:S4N4.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,(5)为解答的难点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据元素在周期表中的位置,推测元素的原子结构 | |
| B. | 指导新元素的发现和合成,预测新元素的性质 | |
| C. | 在金属与非金属的分界线附近寻找半导体材料 | |
| D. | 在零族元素中寻找耐腐蚀的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
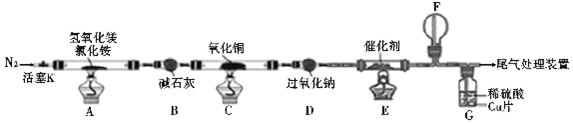
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ③④⑥ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
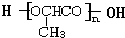 +(n-1)H2O.
+(n-1)H2O.
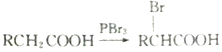
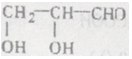 (己知同一个碳原子上不能连接2个羟基)
(己知同一个碳原子上不能连接2个羟基)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CHCH3,分子中的四个碳原子在同一直线上 | |
| B. | 乙醛能使溴水出现褪色觋象,是因为乙醛发生了氧化反应 | |
| C. | 在酸性条件下,CH3CO18OCH2CH3的水解产物是CH3COOH和CH3CH218OH | |
| D. | 聚合物(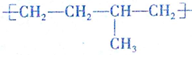 )可由单体CH3CH=CH2和CH2=CH2加聚制得 )可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该浓硝酸中HNO3的物质的量浓度是14.0mol/L | |
| B. | 加入NaOH溶液的体积是50mL | |
| C. | 浓硝酸在与合金反应中起了酸性和氧化性的双重作用 | |
| D. | 得到的金属氢氧化物的沉淀为3.12克 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com