
| A.氨气是生产硝酸的重要原料 | B.甲烷与氯气反应可制得纯净的一氯甲烷 |
| C.铁制容器可用来盛放稀硝酸 | D.油脂经皂化反应可获得高级脂肪酸 |
科目:高中化学 来源:不详 题型:单选题
| A.用铝锅炒菜比用铁锅好 |
| B.Fe2O3俗称铁红,常用作红色油漆和涂料 |
| C.黑色的FeO不溶于水,也不溶于盐酸 |
| D.FeSO4溶液在空气中可长期存放,不会变质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.赤铁矿的主要成分是Fe3O4 |
| B.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入适量氯气 |
| D.Fe3+与KSCN反应产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.铁红可用作红色涂料 |
| B.小苏打可用于治疗胃酸过多 |
| C.铁是地壳中含量最多的金属元素 |
| D.高压钠灯透雾性强,可用于公路两旁的照明灯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.05 | B.0.5 | C.0.55 | D.1.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
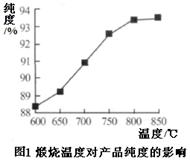
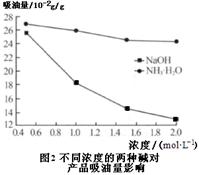
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
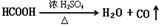 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
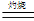 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
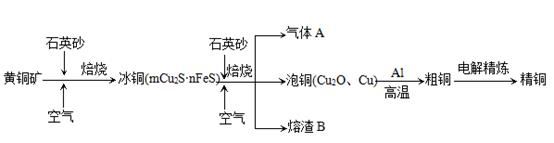
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com