
| A、反应开始时速率v(HCl)>v(CH3COOH) |
| B、加入的锌质量相等 |
| C、盐酸中锌有剩余 |
| D、反应开始后不久,醋酸反应的速率小于盐酸 |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
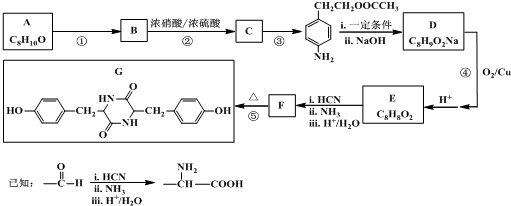
查看答案和解析>>
科目:高中化学 来源: 题型:
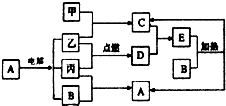 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有蓝色沉淀 |
| B、有蓝色沉淀和气体产生 |
| C、有气体产生,无沉淀生成 |
| D、无沉淀和有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、HClO是弱酸,所以NaClO是弱电解质 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| A、SO2的消耗速率等于SO3的生成速率 |
| B、SO2的生成速率等于SO3的生成速率 |
| C、SO2的消耗速率大于O2生成速率的2倍 |
| D、SO3的生成速率等于O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
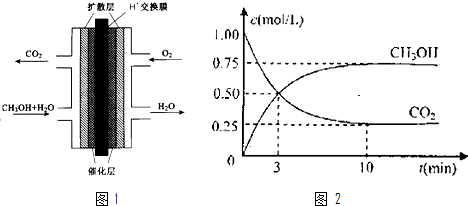
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| B、镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
| C、电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为NA |
| D、在lL0.lmol.L-1碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com