
【题目】在250mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。取此溶液20mL,用水稀释至100 mL,稀释后该硫酸盐的物质的量浓度为
A.2 mol·L﹣1 B.0.4 mol·L﹣1 C.0.8 mol·L﹣1 D.1.2mol·L﹣1
科目:高中化学 来源: 题型:
【题目】从实验室加热氯酸钾与MnO2的混合物制氧气后的剩余物中回收二氧化锰的操作顺序正确的是
A.溶解、过滤、蒸发、洗涤 B、溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤、 D.溶解、洗涤、过滤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,其中Pb(BF4)2为可溶于水的强电解质,用该铅蓄电池分别电解AgNO3溶液和Na2SO3溶液,装置如下图,a、b、c、d电极材料均为石墨,通电时a电极质量增加。
2Pb(BF4)2+2H2O,其中Pb(BF4)2为可溶于水的强电解质,用该铅蓄电池分别电解AgNO3溶液和Na2SO3溶液,装置如下图,a、b、c、d电极材料均为石墨,通电时a电极质量增加。
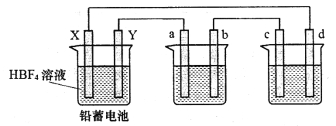
回答下列问题:
(1)d电极为该装置的___________极,工作时,该池内d电极上无气体产生,写出该池内电解反应的离子方程式:_____________________。
(2)该铅蓄电池放电时X极附近pH_____________ (填“增大”、“减小”或“不变”),正极的电极反应式为______________________。
(3)铅蓄电池充电时,Y电极与电源的_________(填“正极”或“负极”)相连。
(4)另取一常规铅蓄电池(浓硫酸作电解质溶液)与该铅蓄电池同时放电,当电路中均通过1 mol电子时,分别取下Y电极称重,两电极质量相差__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列与化学有关的说法正确的是
A. 胺态氮肥和草木灰混合使用可增加肥效
B. 氢氟酸刻蚀水晶饰品体现其酸性
C. 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法
D. 煤经过气化和液化等物理变化可转为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
B.500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
C.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2 (g);△H=-283.0 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中处处有化学,化学是人类进步的关键。下列表述错误的是
A. 汽车排放的尾气和冬季取暖排放的颗粒污染物是形成雾霾的一个因素
B. 泡沫灭火器中用的是小苏打和硫酸铝
C. 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同
D. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.化学只研究自然界中存在的物质
B.化学的特征是认识分子和制造分子
C.通过化学方法可以制造出使人长生不老的“仙丹”
D.化学的研究层面越来越广,原子核的变化也已成为化学研究的范畴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO![]()
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是研究化学反应的有效方法。
Ⅰ.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
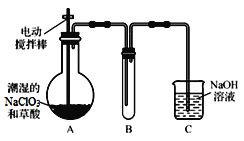
(1)实验时装置A需在60℃~100℃进行的原因是 ,控制所需温度的方法是 。
(2)电动搅拌棒的作用是 。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为 。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式 。
Ⅱ. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是_______________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:

分析上图能够得出的实验结论是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com