能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式:
①2H
2(g)+O
2(g)═2H
2O(l)△H
1=-570kJ?mol
-1;
②H
2(g)+
2O
2(g)═H
2O(g)△H
2=-242kJ?mol
-1;
③C(s)+
O
2(g)═CO(g)△H
3=-110.5kJ?mol
-1;
④C(s)+O
2(g)═CO
2(g)△H
4=-393.5kJ?mol
-1;
⑤CO
2(g)+2H
2O(g)═2CH
4(g)+2O
2(g)△H
5=+890kJ?mol
-1回答下列问题:
(1)上述反应中属于吸热反应的是
.
(2)H
2的燃烧热为
.
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然难直接测定,但可通过间接的方法求得.已知C(s)+H
2O(g)═H
2(g)+CO(g)△H
6=a kJ?mol
-1;则a=
;该反应的熵△S
0 (选填“>”、“=”或“<”).
(4)C(s)+CO
2(g)═2CO(g)△H
7=
.
(5)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ.又知一定条件下,Al能将C从CO
2置换出来,写出此置换反应的热化学方程式
.



 寒假学与练系列答案
寒假学与练系列答案
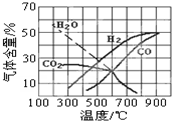 (4)△H3=
(4)△H3=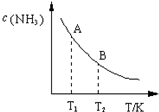 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题: