
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1 mol•L-1(NH4)2SO4溶液与0.2 mol•L-1NH4CI溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.2NA |
分析 A.C3H6可能为丙烯,也可能为环丙烷;
B.溶液体积未知;
C.气体状况未知;
D.硫酸氢铵为强电解质完全电离产生铵根离子、氢离子、硫酸根离子,溶液中水电离产生氢离子和氢氧根离子,氨根离子水解生成等量的氢离子.
解答 解:A.C3H6可能为丙烯,也可能为环丙烷,丙烯含有碳碳双键,环丙烷不含碳碳双键,所以无法确定混合物中含有双键数目,故A错误;
B.溶液体积未知,无法计算氨根离子数目,故B错误;
C.气体状况未知,Vm未知,不能计算混合气体的物质的量,无法计算消耗氧气的物质的量,故C错误;
D.硫酸氢铵为强电解质完全电离产生铵根离子、氢离子、硫酸根离子,溶液中水电离产生氢离子和氢氧根离子,氨根离子水解生成等量的氢离子,所以含0.1molNH4HSO4的溶液中,阳离子数目略大于0.2NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,注意盐类水解性质及应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
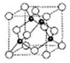 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.| 能级(I) | I1 | I2 | I3 | I4 | I5 |
| 电离能/kJ•mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
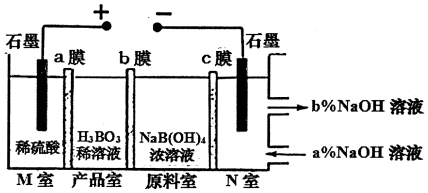
| A. | M室发生的电极反应式:2H2O-4e-═O2↑+4H+ | |
| B. | N室:a%<b% | |
| C. | 产品室发生的反应是:B(OH)4-+H+?H3BO3+H2O | |
| D. | 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: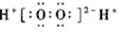 | B. | CCl4的电子式: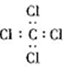 | ||
| C. | ${\;}_{\;}^{18}$O的原子结构示意图: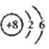 | D. | MgCl2的电子式: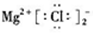 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将硝酸亚铁加入稀硫酸中充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 硫酸有强氧化性 |
| B | Na[Al(OH)4]溶液中滴入NaHCO3 | 产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| C | Na2CO3溶液中滴入酚酞 | 溶液变红 | 能水解的盐溶液中的水的电离度一定比纯水的大 |
| D | 将少量氯水滴在淀粉-KI试纸上 | 试纸中间褪色,试纸边缘变蓝 | 氯气既有氧化性又有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
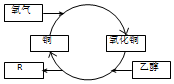
| A. | R的化学式为C2H4O | |
| B. | 乙醇发生了还原反应 | |
| C. | 反应过程中固体有红黑交替变化的现象 | |
| D. | 乙二醇(HO-CH2-CH2-OH)也能发生类似反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| B. | 煤的干馏、煤的汽化和煤的液化都属于化学变化 | |
| C. | 自来水厂用明矾净水,用Fe2(SO4)3或ClO2代替明矾净水,其原理相同 | |
| D. | 将水中的铁闸门连接电源的负极而防腐,是外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所选主要仪器(铁架台等忽略) | 部分操作 |
| A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线 |
| B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
| C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管 | 温度计水银球插入液液面以下 |
| D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com