
| A. | HF、H2O的沸点比HCl、H2S的沸点高很多 | |
| B. | 正戊烷的沸点比新戊烷的沸点高 | |
| C. | 邻羟基苯甲酸的沸点比对羟基苯甲酸的低 | |
| D. | Na2O的熔点比MgO的熔点低 |
分析 A.氢化物的熔沸点与分子间作用力成正比,分子间作用力越大,其熔沸点越高,且分子间氢键导致物质熔沸点较高;
B.同分异构体的分子晶体中,支链越多其熔沸点越低;
C.含有分子间氢键的物质导致其熔沸点较高,分子内含有氢键的物质熔沸点较低;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比.
解答 解:A.氢化物的熔沸点与分子间作用力成正比,分子间作用力越大,其熔沸点越高,分子间氢键的物质导致其熔沸点较高,HF、H2O都含有氢键,而HCl、H2S都不含氢键,所以HF、H2O的沸点比HCl、H2S的沸点高很多,可以用分子间作用力解释,故A不选;
B.同分异构体的分子晶体中,支链越多其熔沸点越低,前者支链较少,所以正戊烷的沸点比新戊烷的沸点高,可以用分子间作用力解释,故B不选;
C.含有分子间氢键的物质导致其熔沸点较高,分子内含有氢键的物质熔沸点较低,前者形成分子内氢键、后者形成分子间氢键,所以邻羟基苯甲酸的沸点比对羟基苯甲酸的低,可以用分子间作用力解释,故C不选;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,二者都是离子晶体,且钠离子半径大于镁离子,而电荷小于镁离子,所以Na2O的熔点比MgO的熔点低,不能用分子间作用力解释,故D选;
故选D.
点评 本题考查分子间作用力与物质熔沸点关系,为高频考点,金属晶体熔沸点与金属键有关、离子晶体熔沸点与晶格能有关、原子晶体熔沸点与化学键有关、分子晶体熔沸点与分子间作用力和氢键有关,明确晶体类型与晶体熔沸点影响因素是解本题关键,注意分子晶体稳定性与化学键有关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | X:氯化铝溶液,Y:氨气 | |
| B. | X:硅酸钠溶液,Y:二氧化硫 | |
| C. | X:氢氧化钡溶液,Y:一氧化碳 | |
| D. | X:四羟基合铝酸钠溶液,Y:二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 当B、C、D三种物质,它们的物质的量nB:nC:nD=2:1:1 | |
| D. | 混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①⑥ | C. | ④⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
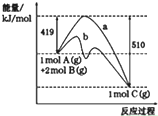
| A. | 曲线b表示使用催化剂后的能量变化 | |
| B. | 正反应活化能大于逆反应活化能 | |
| C. | 由图可知该反应的焓变△H=+91 kJ•mol-1 | |
| D. | 反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 第二周期 | Li | Be | B | C | N | O | F |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
| 第三周期 | Na | Mg | Al | Si | P | S | Cl |
| 电负性值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
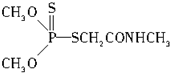
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CsOH是一种既可与强酸又可与强碱反应的两性氢氧化物 | |
| B. | Cs在空气中燃烧可生成Cs2O和Cs2O2 | |
| C. | Cs与水反应,能发生爆炸,并放出H2 | |
| D. | CsOH很稳定,加热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | aL气体的平均相对分子质数为41.3 | |
| B. | aL气体被水吸收时转移电子的物质的量为($\frac{2m}{170}-\frac{b}{108}$)mol | |
| C. | cL剩余气体是O2,且c=$\frac{a}{4}$ | |
| D. | 将mgAgNO3溶于水,再加足量的盐酸,$\frac{b}{108}$×143.5g可生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| D. | 酸式滴定管尖嘴部分开始实验时有气泡,滴定后无气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com