
右图曲线a表示放热反应X(g)+Y(g)  Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b
Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b
曲线进行,可采取的措施是
A、升高温度 B、加大X的投入量
C、加催化剂 D、增大体积
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
下列制定微粒的数目相等的是
A.等物质的量的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有的共用电子对数
C.同温.同压同体积的CO和NO含有的质子数
D.等物质的量的铁和铝分别于足量氯气完全反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1 mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2 L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________________________________________________。
(2)混合气体的平均摩尔质量是_____________________________________________。
(3)CO2和CO的体积之比是____________________________________________________。
(4)CO的体积分数是_________________________________________________。
(5)CO2和CO的质量之比是_____________________________________________________。
(6)CO的质量分数是____________________________________________________。
(7)混合气体中所含氧原子的物质的量是_____________________________________。
(8)混合气体中所含碳原子的物质的量是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程表达式中,属于电离方程式的是
A.HCO3- + H2O 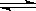 H2CO3 + OH- B.HCO3- + OH- ==== H2O + CO32-
H2CO3 + OH- B.HCO3- + OH- ==== H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O 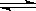 NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应:N2+O2 2NO,在密闭容器中进行,下列条件能加快反应速率的是
2NO,在密闭容器中进行,下列条件能加快反应速率的是
A、降低温度 B、体积不变充入N2使压强增大
C、体积不变充入He使气体压强增大 D、保持总压强不变,充入Ne气体
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒压下,在容积可变的器皿中,反应2NO2(g)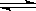 N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A、不变 B、 增大 C、 减少 D、 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物甲、乙、丙有如下转化关系:
甲(C4H10O) 乙(C4H8)
乙(C4H8) 丙(C4H8Br2)
丙(C4H8Br2)
请回答下列问题:
(1)甲中官能团的名称是________,甲属________类物质,甲可能的结构有________种,其中可催化氧化为醛的有________种。
(2)反应条件①为________,条件②为________。
(3)甲→乙的反应类型为______________,乙→丙的反应类型为________________。
(4)丙的结构简式不可能是________(填字母)。
A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是( )
A.在该条件下,反应前后的压强之比为1∶1
B.若反应开始时容器容积为2 L,则v(SO3)=0.35 mol·L-1·min-1
C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol
D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com