
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5 mol/L,则此时v(正)>v(逆) | |
| D. | 80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125 mol/L |
分析 A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,据此判断;
B.相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数;
C.计算常数的浓度商Qc,与平衡常数比较,判断反应进行方向,据此判断;
D.根据80℃平衡常数计算Ni(CO)4的平衡浓度.
解答 解:A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A错误;
B.25°C时反应Ni(s)+4CO(g)?Ni(CO)4(g)的平衡常数为5×104,相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数,故25°C时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为$\frac{1}{5×1{0}^{4}}$=2×10-5,故B正确;
C.浓度商Qc=$\frac{0.5}{0.{5}^{4}}$=8,大于80°C平衡常数2,故反应进行方向逆反应进行,故v(正)<v(逆),故C错误;
D.80℃达到平衡时,测得n(CO)=0.3mol,c(CO)=$\frac{0.3mol}{0.3L}$=1mol/L,故c[Ni(CO)4]=K•c4(CO)=2×14mol/L=2mol/L,故C错误;
故选B.
点评 本题考查化学平衡常数及影响因素、化学平衡常数有关计算等,题目难度中等,明确化学平衡的影响因素为解答关键,注意掌握化学平衡常数的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | Na2SO4固体 | C. | NH4Cl饱和溶液 | D. | CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K值越大,表明该反应越有利于C的生成 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度越高,K一定越大 | |
| D. | 如果m+n=p,则K=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
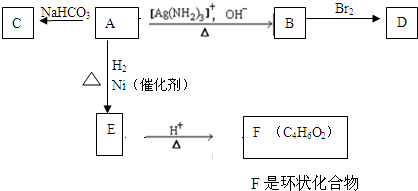
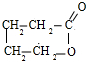 .由E生成F的反应类型是酯化反应.
.由E生成F的反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,v正、v逆都发生变化且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数;该反应的平衡常数K不变 | |
| C. | 降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数;该反应的平衡常数K增大 | |
| D. | 加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
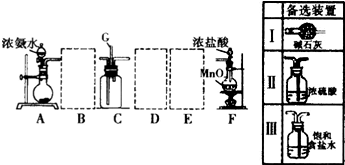
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2C3水解生成C3H4 | B. | Li2C2水解生成C2H4 | ||
| C. | Al4C3水解生成C3H4 | D. | ZnC2水解生成C2H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com