
常温时,下列叙述正确的是
A. pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+)
B. pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍
C. AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D. 1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
把镁带投入盛有盐酸的敞口容器里,下列因素对反应速率有影响的是
①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度
A.①② B.③④ C.①②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
(15分)现有分子式为C10H10O2Br2的芳香族化合物X,X中苯环上有四个取代基,苯环上的一氯代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。

已知:
① 在稀碱溶液中,连在苯环上的溴原子不易发生水解
②两个羟基同时连在同一碳原子上的结构是不稳定的,它将自动发生脱水反应:
CH3CH(OH) 2→CH3CHO +H2O
回答下列问题:
(1)X中官能团的名称是 ,C的结构简式为
(2)E→F反应类型是
(3)I的结构简式为 ;
(4)E不具有的化学性质 (选填序号)
A、取代反应 B、消去反应 C、氧化反应 D、1molE最多能与1mol NaHCO3反应
(5)写出下列反应的化学方程式:
① X与足量稀NaOH溶液共热的化学方程式:
② B→C的化学方程式: ;
(6)同时符合下列条件的E的同分异构体共有 种,
A、苯环上的一氯代物有两种 B、不能发生水解反应
C、遇FeCl3溶液不显色 D、1molE最多能分别与1molNaOH和2molNa反应
其中核磁共振氢谱为六组峰,且峰面积比为3:2:2:1:1:1的一种结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
A.X元素的氢化物的水溶液显碱性
B.Z元素的单质在一定条件下能与X元素的单质反应
C.Z元素的离子半径大于W元素的离子半径
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列溶液中离子浓度的关系一定正确的是
A. 和
和 溶液中:
溶液中:
B.一元弱碱MOH对应的盐MCl溶液中:
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:

查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列化学用语不能正确解释相关事实的是
A.碱性氢氧燃料电池的正极反应:H2 - 2e- + 2OH-=== 2H2O
B.用电子式表示NaCl的形成过程:
C.向含有Hg2+的废水中加入Na2S可除去Hg2+:Hg2+ + S2- === HgS↓
D.汽车尾气系统的催化转化器可降低NO等的排放:2CO + 2NO  2CO2 +N2
2CO2 +N2
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高三5月校统测理科综合化学试卷(解析版) 题型:填空题
【化学-选修3物质结构与性质】(15分)
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 .
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 .简述你的判断依据 .
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为 。

(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为 .
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。
 、
、
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是
| 已知 | 类推 |
A. | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
B. | 向稀硫酸中加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液中加入Ba(OH)2溶液至中性 H++OH-=H2O |
C. | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
D. | 向Ca(OH)2溶液中通入过量CO2 CO2 + OH- = HCO3- | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |
查看答案和解析>>
科目:高中化学 来源:2013-2014上海市黄浦区高三二模化学试卷(解析版) 题型:实验题
(本题共12分)
我国利用生产磷铵[(NH4)3PO4]排放的废渣磷灰石制取硫酸并联产水泥的技术研究获得成功。已知磷灰石的主要成分是Ca3(PO4)2,具体生产磷铵流程如下:
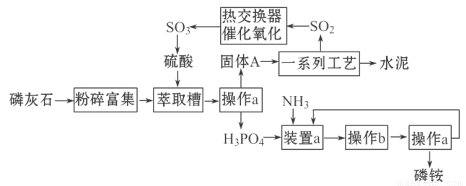
38.操作a的名称是___________,实验室中进行此操作的非玻璃仪器用品有___________;在实验室中操作b的名称是______________________。
39.装置a中生成两种酸式盐,它们的化学式分别是_______________________。
40.固体A中一定含有的物质,其化学式是_________________。
41.热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是________________________。
42. 制硫酸所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是__________。
a.NaOH溶液、酚酞试液 b.KMnO4溶液、稀硫酸
c. 碘水、淀粉溶液 d.氨水、酚酞试液
所用的测量方法为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com