
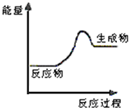
 现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
现有反应:A CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑分析 (1)图1为生成物能量大于反应物能量,则该反应为吸热反应,根据是否有化合价变化判断是否为氧化还原反应;
(2)2SO2(g)+O2(g)?2SO3(g)该反应属于放热反应,可逆反应不可能完全转化,所以向密闭容器中通入2molSO2和1molO2,放出热量小于197KJ,可通过使用催化剂,增大压强,升高温度的方法来加快反应速率;
(3)能设计成原电池的反应通常是放热反应,依据原电池原理可知必须是氧化还原反应;
①发生氧化反应的为负极,发生还原反应的为正极;
②依据电子转移守恒计算和分析两个电极变化;
(4)电解饱和食盐水反应生成NaOH、H2、Cl2,反应方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,根据蓄电池的电极反应得电池反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,根据串联电路中转移电子的物质的量相等进行计算.
解答 解:(1)由图1为生成物能量大于反应物能量,则该反应为吸热反应,有化合价变化的是为氧化还原反应,则只有C为吸热的氧化还原反应,故选:C;
(2)2SO2(g)+O2(g)?2SO3(g)该反应属于放热反应,可逆反应不可能完全转化,所以向密闭容器中通入2molSO2和1molO2,放出热量小于197KJ,可通过使用催化剂,增大压强,升高温度的方法来加快反应速率,故答案为:放热;<;使用催化剂;
(3)设计原电池需要反应发生的是氧化还原反应,原电池的反应通常是放热反应,比较分析可知AD为非氧化还原反应,B为放热反应的氧化还原反应,C为吸热反应的氧化还原反应,所以B符合原电池设计原理的要求,故答案为:B;
①由原电池总反应Zn+H2SO4═ZnSO4+H2↑,其中负极材料是锌,发生氧化反应,溶液中氢离子得到电子在正极生成氢气,电极反应2H++2e-=H2↑,原电池中阴离子向负极移动,故答案为:锌;氧化;2H++2e-=H2↑;负;
②当导线中有1mol电子通过时,负极锌物质的量减小0.5mol,质量减小0.5mol×65g/mol=32.5g;正极上放出氢气,根据电子守恒生成氢气的物质的量0.5mol,质量为0.5mol×2g/mol=1g,所以选项中bc正确;
故答案为:bc;
(4)电解饱和食盐水反应生成NaOH、H2、Cl2,该反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,根据PbO2+Pb+2H2SO4═2PbSO4+2H2O知,电池参加反应硫酸的物质的量为0.20mol,则转移电子的物质的量为0.2mol,产生氯气的物质的量为0.1mol,所以体积为2.24L,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;2.24L.
点评 本题考查了原电池的设计、原理的分析和应用,主要是电极反应及其相关计算,电极产物判断,掌握基础是关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
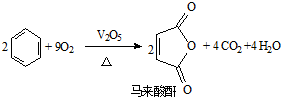
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 ,青蒿素分子式为C15H22O5.
,青蒿素分子式为C15H22O5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NaHCO3溶液与NaOH反应:HCO3-+OH-═CO2↑+H2O | |
| C. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| D. | 向氢氧化钡溶液中通入少量二氧化硫气体:2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
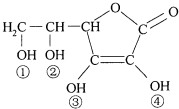 维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )
维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( )| A. | 维生素C由于含有C═O键而能发生银镜反应 | |
| B. | 维生素C由于含有酯基而难溶于水 | |
| C. | 维生素C的分子式为C6H8O6 | |
| D. | 维生素C的酸性可能是①、②两个羟基引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )| A. | 消耗22.4 LCO2可制得1mol乙酸 | |
| B. | 该反应过程符合“绿色化学”原理,其原子利用率为100% | |
| C. | 该反应属于取代反应 | |
| D. | 反应物和生成物中均含有极性键和非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 类别 | 物质 |
| A | 碱性氧化物 | Na2O2 Al2O3 MgO |
| B | 酸式盐 | NaHCO3 NaHSO4 NH4Cl |
| C | 弱酸 | H2S H2SO4 CH3COOH |
| D | 强电解质 | AgCl MgSO4 CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com