
【题目】A、B、C、D、E 为原子序数依次增大的短周期元素。A、C处于同一主族,C、D、E 处于同一周期,E 原子的最外层电子数是 A、B、C原子最外层电子数之和。A、B 组成的常见气体 X 能使湿润的红色石蕊试纸变蓝;D 的单质既能与C元素最高价氧化物的水化物的溶液反应生成盐,也能与A、E 形成的化合物的水溶液反应生成盐。下列说法正确的是( )
A.原子半径的大小顺序:C>D>E>A>B
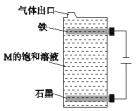
B.C、E组成的化合物M 用右图装置进行电解能得到大量的 E 单质
C.元素B、E的最高价氧化物对应的水化物的酸性:B>E
D.C元素的氧化物中阴、阳离子数目之比为1:2
【答案】D
【解析】
A、B 组成的常见气体 X 能使湿润的红色石蕊试纸变蓝,则A为H、B为N,X为NH3;A与C同族,且C的原子序数大于N,则C为Na,所以E的最外层电子数为1+1+5=7,则E为Cl,D的单质技能与NaOH反应也能与HCl反应,则D为Al。
A.电子层数越多半径越大,电子层数相同则原子序数越小半径越大,所以原子半径的大小为:Na>Al>Cl>N>H,即C>D>E>B>A,故A错误;
B.C、E组成的化合物为NaCl,如图装置电解饱和氯化钠溶液时,石墨电极为阳极,氯离子放电生成氯气,铁电极为阴极,氢离子放电生成氢气,同时产生大量氢氧根,氯气的密度比水小,无法溶于水的氯气会上浮到铁电极附近与氢氧根反应生成氯离子和次氯酸跟,无法得到大量的氯气单质,故B错误;
C.N的非金属性小于Cl的非金属性,所以最高价氧化物对应的水化物的酸性:N<Cl,故C错误;
D.C元素为Na,其氧化物为Na2O,其中阴、阳离子数目之比为1:2,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
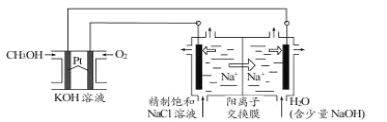
(1)CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH______(填“增大”、“减小”或“不变”),负极反应式为______。
(2)图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。阳极产生ClO2的反应式为______。
(3)电解一段时间,从阴极处收集到的气体比阳极处收集到气体多6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为______mol。
(4)在阴极室中加入少量的NaOH的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是
A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生为探究苯与溴发生反应的原理,用如图所示装置进行了实验。根据相关知识回答下列问题:

(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在装置Ⅲ中可能观察到的现象是______________________________________。
(2)整套实验装置中能防止倒吸的装置有___________________________(填装置序号)。
(3)写出装置Ⅱ中发生反应的化学方程式:_____________________________________。
(4)本实验能不能用溴水代替液溴?___________________________________________。
(5)采用冷凝装置,其作用是_________________________________________________。
(6)Ⅲ装置中小试管内苯的作用是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶“的电化学实验装置如图所示,该装置能将H2O和CO2转化为 O2和燃料(C3H8O),下列说法不正确的是( )
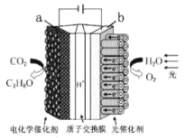
A.该装置工作时,H+从b极区向a极区迁移
B.a电极的反应为:3CO2+18H++18e-= C3H8O +5H2O
C.每生成1moO2, 有44g CO2被还原
D.C3H8O形成燃料电池以氢氧化钠溶液作为电解质溶液的负极反应式C3H8O-18H++24OH-=3CO32-+16H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Wilson病是一种先天性铜代谢障碍性疾病,D-青霉胺具有排铜作用,用以治疗或控制Wilson病症。D-青霉胺结构简式如图:
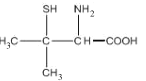
回答下列问题:
(1)写出Cu的简化电子排布式________。
(2)已知气态基态原子得到一个电子形成气态基态负一价离子所产生的能量变化称为该元素原子的第一电子亲合能(吸收能量为负值,释放能量为正值),试解释碳原子第一电子亲合能较大的原因 _________。 第一电子亲合能可能为正值或负值,而第二电子亲合能均为负值,原因是_____。
(3)D-青霉胺中,硫原子的VSEPR模型为____,碳原子的杂化方式为_______。
(4)请简述D-青霉胺能溶于水的主要原因________。
(5)青霉胺在临床治疗时对于症状改善较慢,常有并发症出现,因而近年采用锌剂(ZnSO4)替代治疗,可由硫化锌制备。立方硫化锌晶胞与金刚石晶胞类似,结构如图
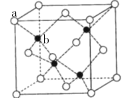
其中a代表S2-,b代表Zn2+。则该晶胞中S2-的配位数为______,若晶体的密度为ρg·cm-3,则晶胞的体积为________ cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是

A. b为正极,电极反应式为:O2+4H++4e-=2H2O
B. 电解质溶液中的H+移向a电极
C. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
D. 呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:R-CH=CH-O-R′(烃基烯基醚)![]() R-CH2CHO + R′OH
R-CH2CHO + R′OH
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
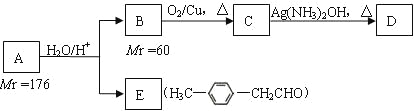
根据题意完成下面小题:
(1)A的分子式为_________________;
(2)B的名称是___________________;A的结构简式为_______________________;
(3)写出C → D反应的化学方程式:__________________________;
(4)写出两种同时符合下列条件的E的同分异构体的结构简式:__________、__________。
① 属于芳香醛;② 苯环上有两种不同环境的氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com